こんにちは!
それでは今回も化学のお話やっていきます。
今回のテーマはこちら!
既にやった原子価結合法に関してはこちらの記事をご覧ください。

動画はこちら↓
動画で使ったシートはこちら(mo)
では早速内容に入っていきます!
分子軌道法の考え方
まずはこのMO法における波動関数の考え方を見ていきます。
MO法では1個の電子は2個の核によって拘束されているという風に考えます。
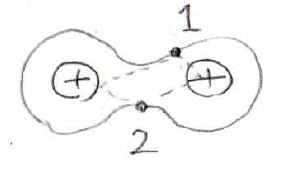
これはつまり水素分子イオンのポテンシャルに拘束された電子が2個存在しているということです。
ということでこれら2つの波動関数の積が全体の波動関数だということになります。
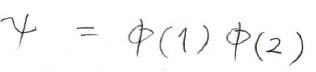
水素分子イオンの波動関数は以前の記事で求めた通りこのようになります。
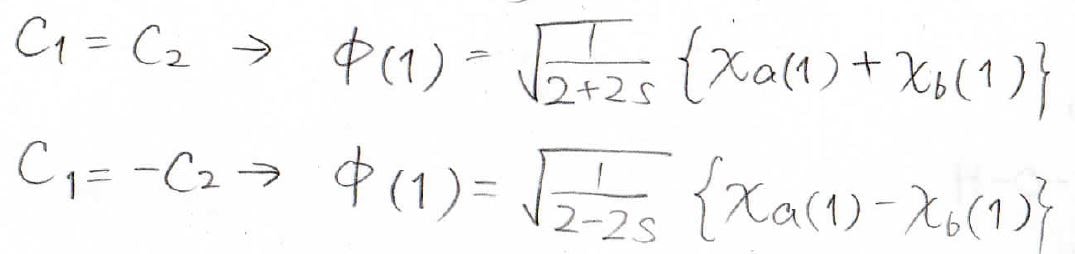
詳しくはこちらの記事をご覧ください。
水素分子の基底状態のエネルギーを計算
それではここから、先ほどの波動関数を使って水素分子の基底状態のエネルギーを求めてみましょう。
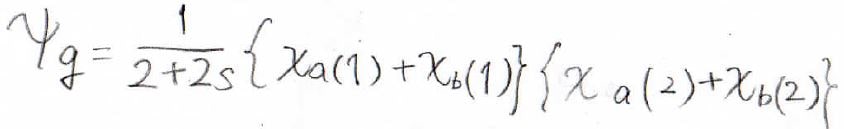
ここで簡単のためハミルトニアンをこのように書き換えておきます。
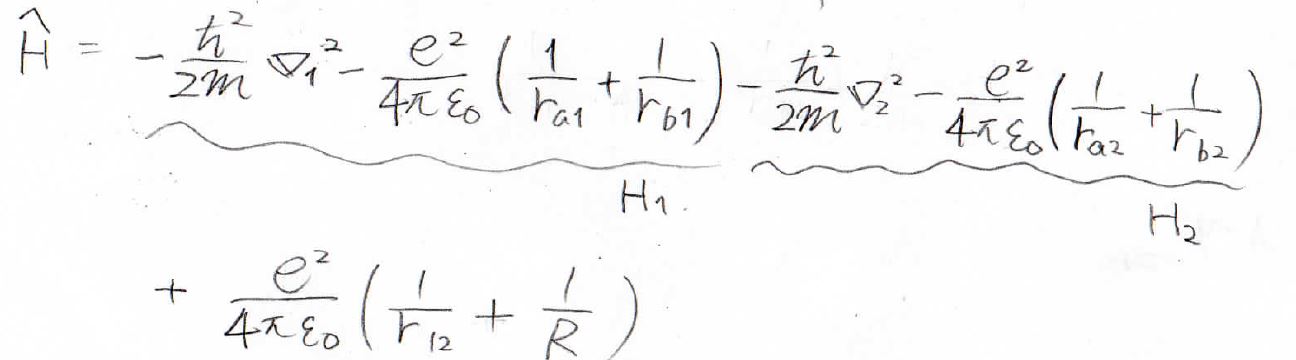
\(1\)の電子の運動に関連するものを\(H_1\)、\(2\)の電子に関連するものを\(H_2\)と表します。
では実際にエネルギーを求めます。
エネルギーは今までやってきたのと同様にこのように書けます。
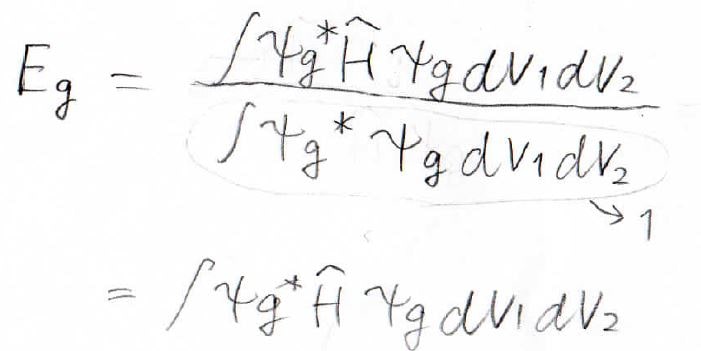
そしてこのように変形していきます。
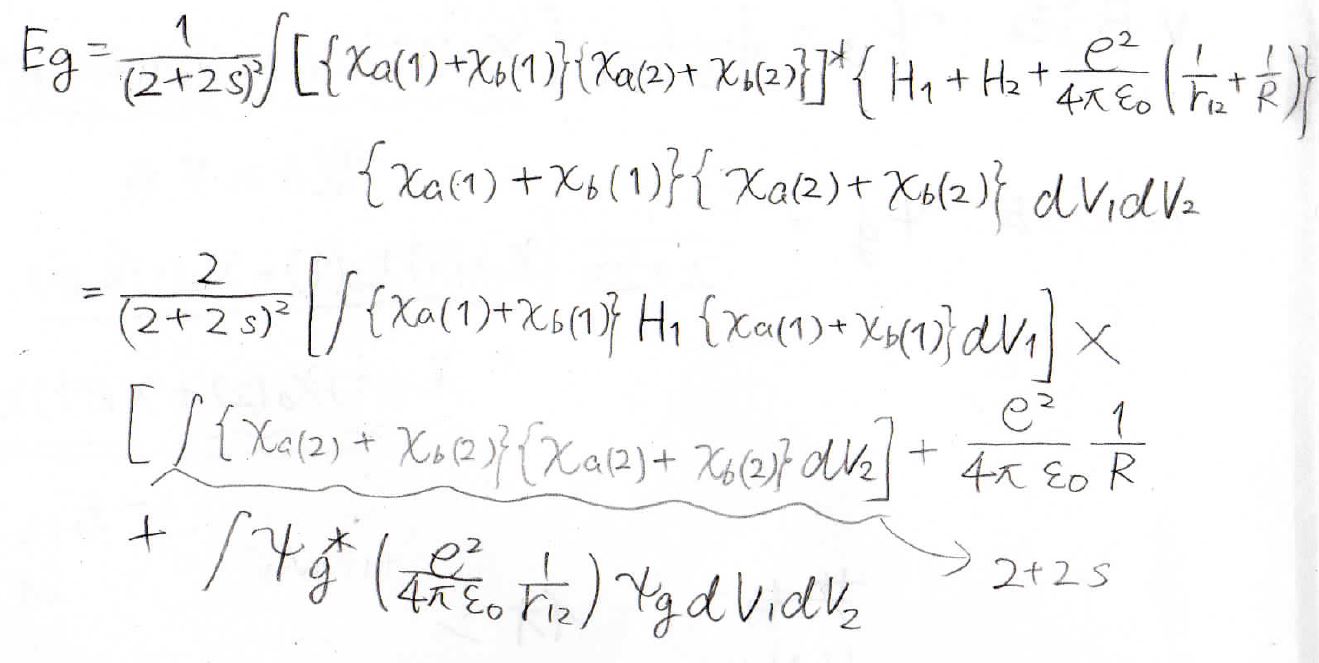
細かく読み上げることはしませんが、水素分子イオンですでにやった計算を駆使することで割と簡単に変形することができます。
最終的に得られたのがこちらの式になります。
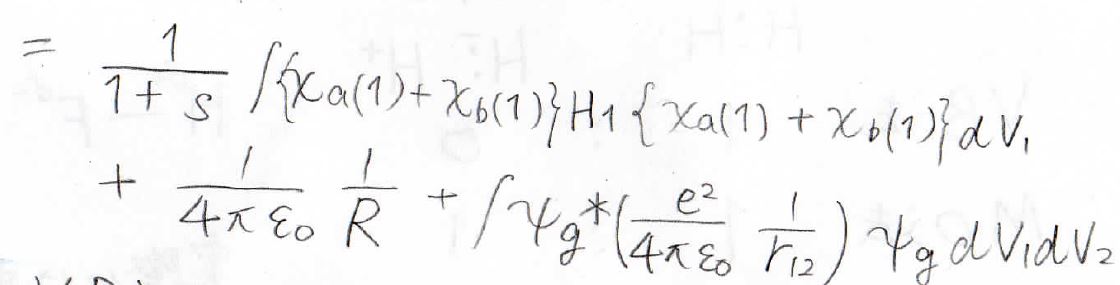
VB法、実験との比較
ではこれが実際の水素分子の結合エネルギーをどれだけ説明しているのかというのを見ていきます。
まずポテンシャルカーブは今まで出てきたものと同様にこのような非調和振動子のものになります。
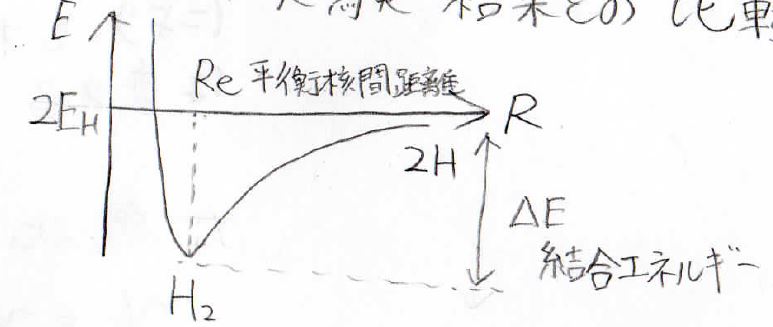
そしてMO法、VB法、実験から求めたエネルギーがそれぞれこのような値になります。

\(R_e\)がポテンシャルが極小をとる平衡核間距離、単位が\(Å\)(オングストローム)、\(10^-10 \rm{m}\)になります。
そしてその時の結合エネルギーが右側になりまして、単位は\(\rm{eV}\)(エレクトロンボルト)です。
この2つのモデルにはいずれも実験値と無視できないほどの差があって、そこまで精度よく水素分子を再現できるものではないということが分かります。
より現実に近い考え方
これの理由を考えるためにVB法とMO法の波動関数を見てみましょう。
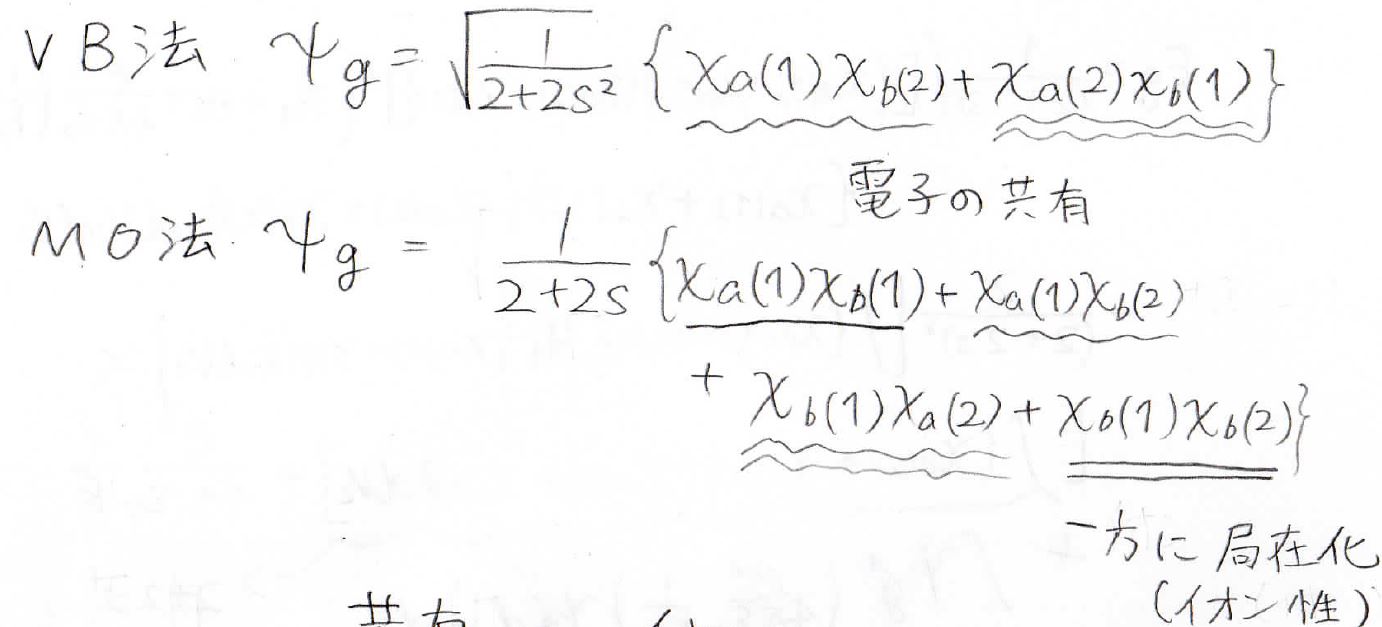
すると、VB法では1つの核につき1個の電子を拘束しているのに対し、MO法では2個の電子が一方の核に拘束されている、すなわちイオン的になっている項が入っています。
すなわちVB法では電子の共有のみを考えていて、MO法では電子の共有結合とイオン結合が1:1の比で効いていることになります。

しかし、実際にある結合ではその電気陰性度の差や共鳴効果によってそれがどれだけイオン結合的になっているのかは変わります。
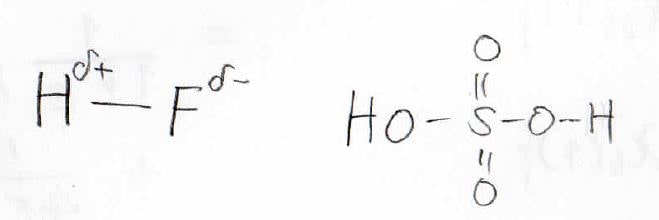
そのため、それぞれの寄与が1:1としか考えられないMO法では実験結果を精度良く予想することができませんでした。
そこで、そのあとにより一般化されたモデルとして、この比を自由に変えられるようにしたものが出てきました。
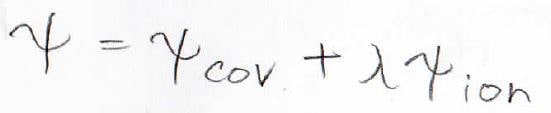
この\(\lambda\)が\(0\)から\(1\)の定数でこれによって共有結合とイオン結合の比を自由に変えられるようになります。
実際の値は電気陰性度などの物理パラメータと変分定理を使って求めることになります。
共有結合とイオン結合ははっきりと分けることができないというこの考え方は、高校の化学から考えるとなかなか受け入れにくいと思いますが、この考え方がないと電子の局在化、酸性度などを考えることができないので、化学のセンスを磨くうえで不可欠な概念になります。
まとめ
それでは今回の内容は以上ですので軽くおさらいをやって終わります。
今回は分子軌道法によって水素分子の結合エネルギーを求めるという話をしました。
MO法では2つの電子のそれぞれが水素分子イオンのポテンシャルにあります。
全体の波動関数はこの2つの電子の波動関数の積になります。
そしてそこからエネルギーを求めて、VB法、実験値と比較しました。
MO法もVB法も実験から得られる結合エネルギーを完全に予測することはできません。
そこで必要になってくる考え方が、共有結合性とイオン結合性の寄与のバランスは結合によって変わってくるというものです。
VB法では共有結合のみ、MO法では共有結合とイオン結合を1:1の寄与で考えていましたが、実際の物質であれば電気陰性度や共鳴効果などの効果もありもっと複雑になるはずです。
そしてこれらを克服するものとして考えられたのがそれらの比を定数\(\lambda\)として、その結合によって寄与が変わるとしたモデルです。
これにより実験結果をより柔軟に説明することができるようになりました。
共有結合とイオン結合は完全に区別するのではなく、どちらも混在したものがほとんどだと思っていただければ、分極、酸性度などの概念もすっきりするので、こういう考え方があるんだなというのは抑えていただければと思います。
それではどうもありがとうございました!