こんにちは!
それでは今日も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(錯体化学1)
それでは内容に入っていきます!
錯体
一般的に錯体とは、単独状態でも存在しうる化学種が配位子となって、金属原子あるいは金属イオンを囲む形で存在しているものを指します。

配位子は、自らの持つ非共有電子対を介して金属原子や金属イオンと結合を形成しており、この結合は特に、配位結合とよばれます。
ルイスの酸・塩基の定義
ルイス酸は、非共有電子対を相手から受け取る化学種のことを言います。
ルイス塩基は、非共有電子対を相手に与える化学種のことを言います。
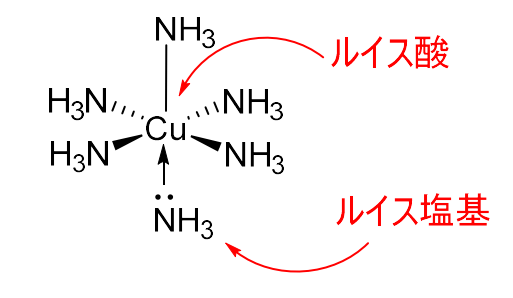
図の例では、\(\displaystyle \rm{Cu}\)がルイス酸、6つの\(\displaystyle \rm{NH}_3\)がルイス塩基にあたります。
内圏錯体と外圏錯体
主に錯体として扱われているものは、内圏錯体、外圏錯体という分類がされます。
内圏錯体とは、一般的な錯体のとおり、中心の金属原子や金属イオンに複数の配位子が直接配位した錯体のことを指します。
このとき、配位した配位子の数を配位数と言います。
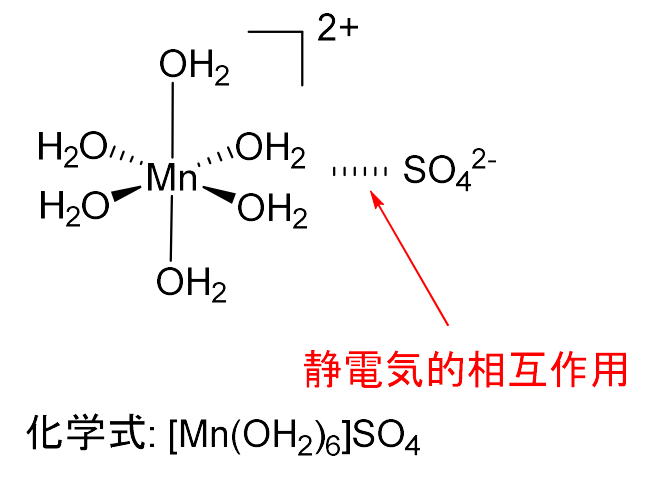
また、外圏錯体は、\(\displaystyle \rm{[Mn(OH_2)_6]SO_4}\)のように、正電荷をもった錯体(以下の図では、\(\displaystyle \rm{[Mn(OH_2)_6]^{2+}}\))が、負電荷をもった配位子(以下の図では、\(\displaystyle \rm{SO_4^{2-}}\))と静電気的な引力で会合したもののことです。
そのとき、すでに結合している配位子の交換は起こりません。
有機金属錯体とWerner型錯体
そのほかによく対比される分類として、有機金属錯体とWerner型錯体があります。
有機金属錯体は、金属と炭素原子、もしくは有機分子との間に結合がある錯体のことを指します。
Werner型錯体とは、金属と配位子のペアが配位結合を成している一般的な錯体のことを指します。
有機金属錯体ではないもの、ぐらいの認識で構いません。
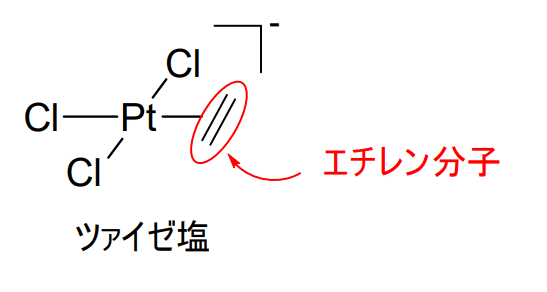
Werner型錯体は、孤立電子対をもつ化学種の配位によってできますが、有機金属錯体の当該結合部分は共有結合性をもっているという特徴があります。
錯体化学の祖 Werner
余談ですが、最後にWernerの業績についてまとめておきます。

19世紀後半、錯体に対する説明を与えたのがWernerでした。
原子価の概念を確立
当時は、同じ元素は必ず同じ結合の本数をもつ、という常識がありました。
例えば、塩化銅には\(\displaystyle \rm{CuCl}\)と\(\displaystyle \rm{CuCl_2}\)の2種類がありますが、\(\displaystyle \rm{Cu}\)は2本の結合をもつと考えられていました。
それに対し、Wernerは\(\displaystyle \rm{CuCl}\)中の\(\displaystyle \rm{Cu}\)の結合は1本であると提案し、元素は原子価を変化させることができる、という考えを築きました。

配位化合物の立体の概念を導入
また、Wernerは配位化合物の立体の概念を導入しました。
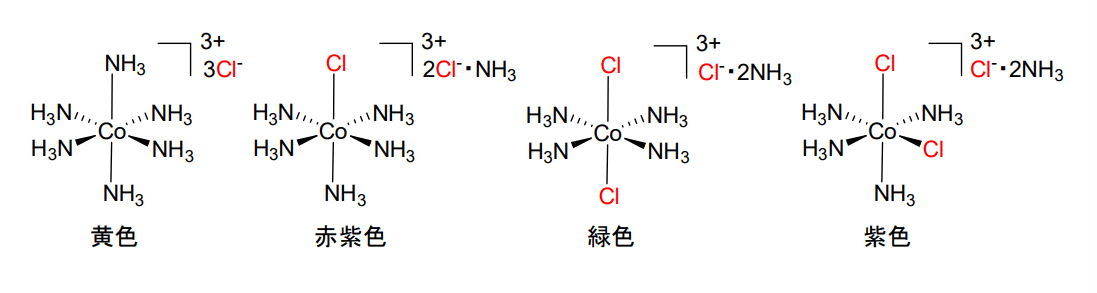
当時は、同じ組成式をもつ\(\displaystyle \rm{CoCl_3(NH_3)_6}\)という化学種が違う色を示すことがあるという現象を説明できませんでした。
そこでWernerは、以下の図のような6配位型の立体モデルを考案し、9つの\(\displaystyle \rm{Cl^-}\)および\(\displaystyle \rm{NH_3}\)のうち、\(\displaystyle \rm{Co}\)と直接結合している6つの化学種を配位子と名付けました。
また、色の違いは、配位子の選定方法や、選ばれた配位子の立体の違いによると説明しました。
彼の説は、発表当時はなかなか受け入れられませんでしたが、実験を重ねるにつれて正しさが検証されていき、1913年にはノーベル化学賞が送られました。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)
かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!




