こんにちは!
それでは今日も化学のお話やっていきます。
今回のテーマはこちら!
動画で使ったシートはこちら(錯体化学2)
それでは内容に入っていきます!
配位子
錯体化学の基礎用語解説のパートでも軽く触れましたが、金属に非共有電子対を供与することで、金属と配位結合を成している化学種のことを言います。
配位子は錯体化学のコアとなるもので様々な研究の対象となっています。
ここでは、配位子の性質に基づく分類を行うとともに、筆者の好みも交えつつ実際に見かけることが多い印象のある、代表的な配位子を紹介していきます。
単座配位子
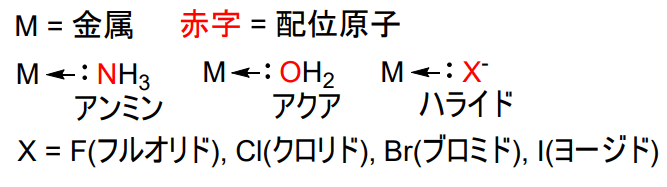
金属原子と直接配位結合をしている配位子中の原子を配位原子と言います。これを一つもつ配位子を単座配位子と言います。
その代表例として以下の配位子を紹介します。これらの配位子のうち、アクアとアンミンは中性の分子の形で、ハライドはイオンの形で配位します。
二座配位子
配位原子を二つもつ配位子を二座配位子と言います。
一つの原子を二つ以上の配位原子で挟み込むように配位することをキレート配位と呼び、あとで説明するキレート効果により錯体が安定することが知られています。
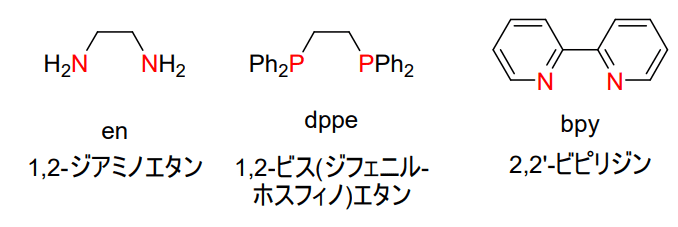
アミノ基を二つもつジアミン系配位子の代表として1,2-ジアミノエタン、略してen、置換基のついたリンを二つもつホスフィン系配位子の代表として1,2-ビス(ジフェニルホスフィノ)エタン、略してdppe、炭素との間に二重結合がある窒素を二つもつジイミン系配位子の代表として2,2’-ビピリジン、略してbpyの構造を示します。
これらは略号で表されることが多い配位子ですが、どんな構造をしているか、特に配位原子(en、bpyは窒素、dppeはリン)は何であるのかを把握しておきましょう。
多座配位子
一般に配位原子を二つ以上もつ配位原子を多座配位子と言います。
また、一つの配位子と中心金属がもつ配位結合の数を多座数と呼びます。
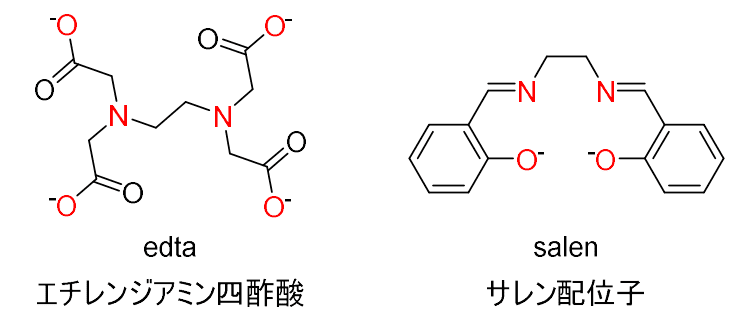
多座配位子の例として、エチレンジアミン四酢酸、略してedtaと、サレンを紹介します。
Edtaは、以下の図のような構造をもち、カルシウム、鉄、銅イオンなどの特定の金属とのみ、金属:配位子=1:1で強く錯形成をする性質があります。
この性質を利用したものとして、キレート滴定があります。
これは、edtaと錯形成するイオン種が一つ、ほかのイオン種と混じっている系において、当該のイオン種の濃度を調べることが出来ます。
サレンは、以下の図のような構造をもち、中心金属周りに平面的に配位した構造を取ります。
また、この配位子はサリチルアルデヒドとジアミンから合成されます。
サレン錯体は様々な反応の触媒となりますが、ここでの趣旨を超えるためまた機会がありましたら別の記事でお話いたします。
両座配位子
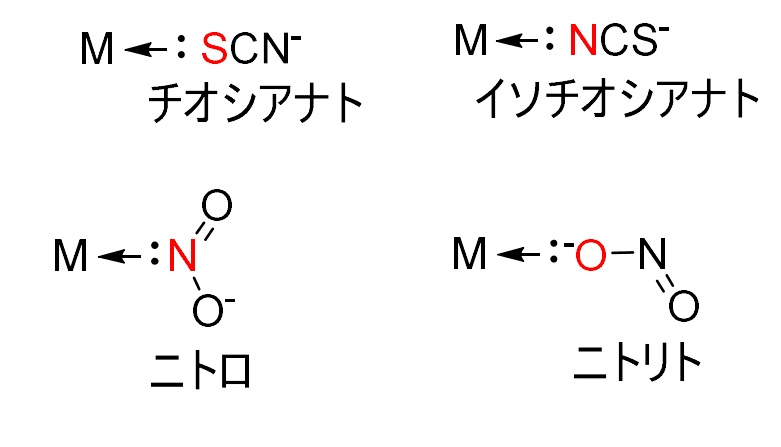
SCN–は、金属原子にS原子で配位する場合と、N原子で配位する場合があります。
このように、異なる種類の配位原子を含む配位子を両座配位子と呼びます。
S原子で配位する場合はチオシアナト、N原子で配位する場合はイソチオシアナトと呼ばれています。
金属やほかの配位子の種類によって、より親和性の高い原子で配位するといった特徴があります。
ほかにはNO2–があり、N原子で配位するとニトロ、O原子で配位するとニトリトと呼ばれています。
大環状配位子
多座配位子のうち、配位原子が環状になったものを、大環状配位子と言います。ここでは、その代表格である、クラウンエーテルを紹介します。
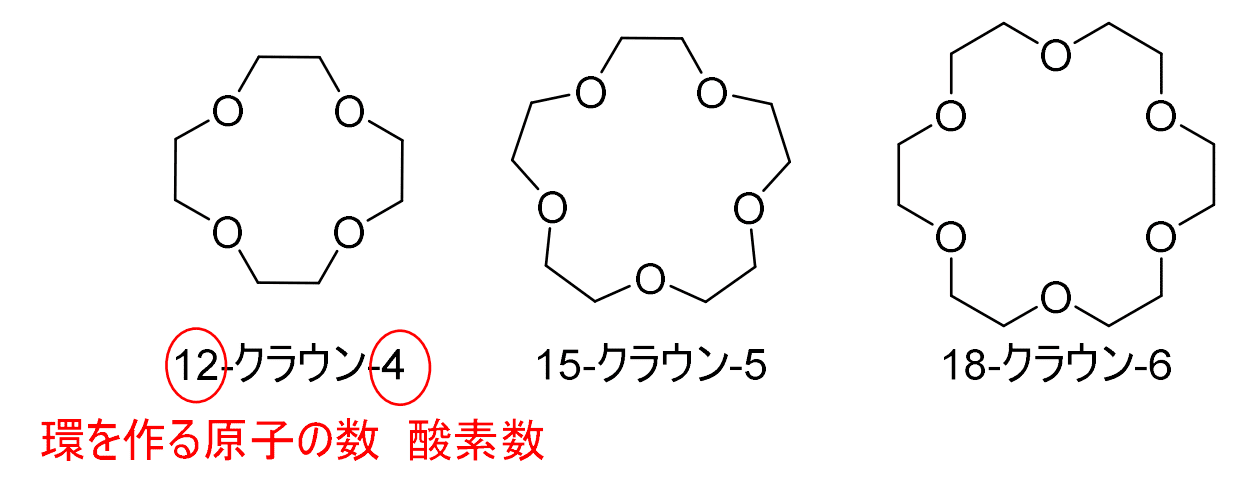
クラウンエーテルのクラウンは王冠という意味で、その名の通り王冠のような形をしており、様々な種類が存在します。
たとえば、12-クラウン-4、15-クラウン-5、18-クラウン-6などがあり、最初の数字は環を構成する原子の数で、最後の数字は環に含まれる酸素原子の数です。
クラウンエーテルは、その大きさによって、その穴に近い大きさの金属を捕捉して、錯形成するという特徴があります。
クラウンエーテルの発見によって、異なる分子間でおきる、様々な相互作用による化学的現象を考察する、超分子化学、という分野が研究され始めるきっかけとなりました。
クラウンエーテルの応用例
ここで化学の勉強が進んでいる人向けに最新のトピックを紹介しておきます。
有機化学においてベンゼン環をこのように還元するバーチ還元というものが知られています。
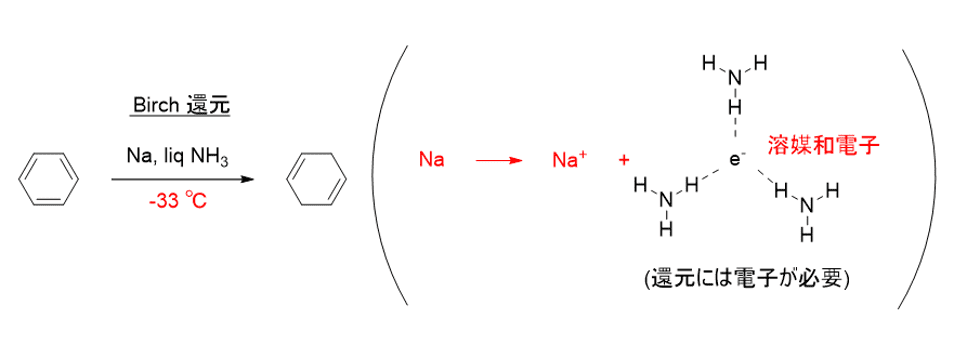
この反応は、金属ナトリウムが吐き出した電子を用いてベンゼン環を上記のように還元する反応です。
このとき、溶媒分子に囲まれて安定化した電子を溶媒和電子と言います。
この電子の安定性を確保するために-33℃の液体アンモニアを溶媒として用いて溶媒和を起こさなくてはならず、替えが効かないわりに取り扱いの難しい反応でした。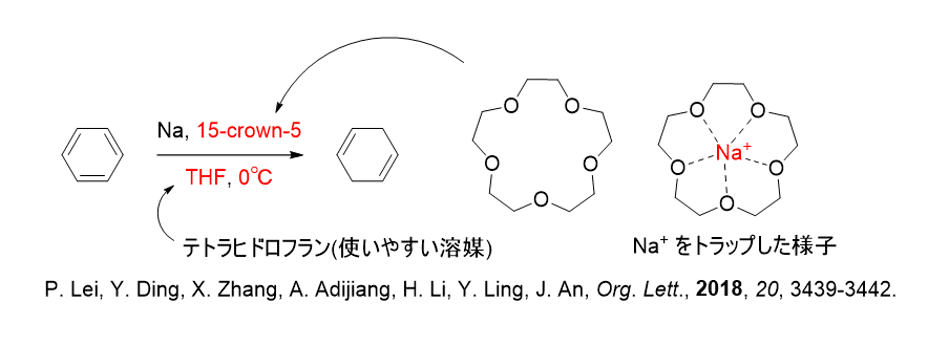
しかし、最近になって金属ナトリウムに15-クラウン-5のクラウンエーテルを作用させると、汎用的な有機溶媒、テトラヒドロフラン中で溶媒和電子が発生する、という現象が確認されており、バーチ還元のハードルが下がることが示唆されています。
キレート効果
キレート効果とは、キレート配位をする配位子が同種の配位原子をもつキレート配位をしない配位子より安定な錯体を形成できることを言います。
この現象を熱力学的視点及び、速度論的視点で考えていきます。
また、このように「熱力学的」と「速度論的」という観点で化学反応を議論することは非常に汎用性が高いので、意識しておきましょう。
速度論的視点による考察
まずは簡単な速度論的効果により考えていきます。
例として二座配位子のbpyが1つとNH3が2つつく反応を考えます。
 金属に対して配位原子が一つ配位したとき、次に二つ目の配位結合が発生しやすいのはどちらでしょうか。
金属に対して配位原子が一つ配位したとき、次に二つ目の配位結合が発生しやすいのはどちらでしょうか。
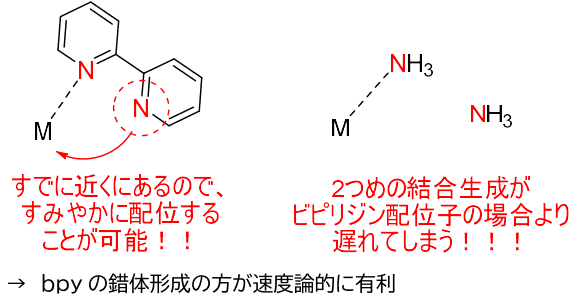
NH3は一回目の配位と同様にまた系内のどこかからNH3を見つけてきて配位しなくてはいけませんが、bpyの配位原子のNはすでに金属の近傍に存在するため、すみやかに二つ目の配位結合が発生します。
このため、配位結合生成速度がキレート配位子の方が大きく、キレート配位子の方が錯形成において速度論的に有利なことがわかりました。
熱力学的視点による考察
次に熱力学的効果について考えていきましょう。
数式を多く用いて考えるやり方もありますが、ここで初学者さんに配慮して定性的な説明を行います。
熱力学的効果を考えるには、反応前と反応後の状態を見比べて、どちらが安定であるかを考えます。
速度論的効果のときと同じ例を用います。
金属にbpyが一つ、もしくはNH3が二つ配位したときの全体の分子数の変化はどうでしょうか。(水を溶媒分子として配位している場合の議論が多いですが、結果は同じなので一般性を重視して溶媒の配位は無視します。)
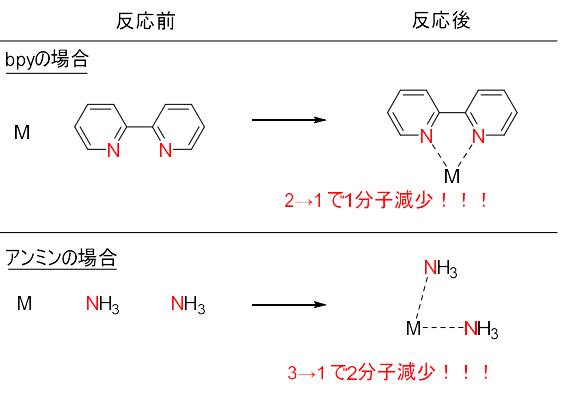
bpyは二つから一つ、NH3は三つから一つです。
さて、ここで系内の乱雑さを示すエントロピーが大きいほど熱力学的に有利である、という事実をふまえると、どちらの反応が起こりやすいでしょうか。
bpyは分子の減少数が1つであるのに対して、NH3は2つ分子が減少するのに系内の乱雑さがbpyに比べて大きく制限されてしまいます。よって、bpyの反応の方が熱力学的に有利であるといえます。
この説明だけでは、どちらもエントロピーが減少しているのにどうしてこの反応は進行するのかという疑問が浮かびます。
これは、反応前後のギブスエネルギー変化を比較することで解決します。
ギブスエネルギー変化(ΔG)は、エンタルピー変化(ΔH)、エントロピー変化(ΔS)と温度(T)を用いてこのように表されます。
ギブスエネルギー変化: \(\Delta G = \Delta H – T \Delta S \)
エントロピー喪失による不安定化ぶんより、結合生成による安定化ぶん(エンタルピー変化)のほうが上回るため反応が進行します。
エンタルピー変化は、どちらの反応でもほとんど同じことが知られています。
以上より、キレート配位子が安定な結合を生成することが化学的に説明できました。
まとめ
はい、今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)
かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!




