こんにちは!
それでは今日も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(conjugated diene)
シートの前半部分は、前回の内容です。

求電子付加反応
ジエンは安定な化学種でありながら、その二重結合への求電子付加反応は、とても速く進行します。
例えば、\(\displaystyle 0^\circ \rm{C}\)\(\)でブタジエンに臭化水素を反応させることで、3-ブロモ-1-ブテンが主生成物として得られます。
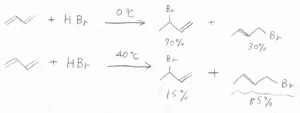
これは、ジエンとプロトンとの反応で、アリルカチオンを経由するためです。
一方で、右に書いてある1-ブロモ-2-ブテンも\(\displaystyle 30\%\)生成します。
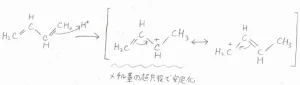
問題なのはむしろここからで、反応させる温度を\(\displaystyle 0^\circ \rm{C}\)\(\)から\(\displaystyle 40^\circ \rm{C}\)\(\)に上げた場合には、1-ブロモ-2-ブテンのほうが選択的に得られるようになります。
1-ブロモ-2-ブテンは内部アルケンなので、メチル基の超共役により熱力学的に安定です。
ただ、アリルカチオン中間体で言えば、3-ブロモ-1-ブテンに近い共鳴構造のほうが寄与が大きくなります。
これをポテンシャル図にすると、こちらのようになります。
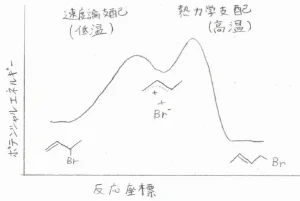
3-ブロモ-1-ブテンができるときの遷移状態は、中間体のより安定なほうの共鳴構造に近いため、低い温度でも反応は速く進行します。
ただ、温度が高い条件では、より熱力学的に安定な1-ブロモ-2-ブテンが多く得られることになります。
これらは、それぞれ速度論支配、熱力学支配であると言います。
ベンゼンなどの芳香族を除く共役トリエンでも、同様の反応が起こります。
trans-1,3,5-ヘキサトリエンに臭素分子を付加させる反応では、3つの共鳴構造が考えられます。

最終生成物のうち、最も熱力学的に安定なのは、共役ジエンかつ内部アルケンである1,6-付加体で、温度が上昇するほど選択的に多く得られることになります。
Diels-Alder反応
次に紹介するのは、Diels-Alder(ディールズ-アルダー)反応と呼ばれる有名な反応です。
ブタジエンとエチレンの混合物を気相中で加熱すると、炭素-炭素結合が形成されて、シクロヘキセンができます。
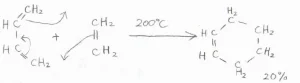
この反応は、\(\displaystyle \pi\)電子系間の環化付加反応の特殊な場合として分類されており、[4+2]環化付加反応とも言います。
この反応において、シクロヘキセンは環化付加物と呼ばれます。
置換基の影響
ただし、ブタジエンとエチレンの反応は、収率\(\displaystyle 20\%\)とあまりきれいな反応とは言えません。
それぞれの化合物の誘導体を使うことで、この反応はより速く進行させることができる組み合わせがあります。
それは、電子不足アルケンと電子豊富ジエンの組み合わせです。
したがって、電子求引基で置換されたアルケンと電子供与基で置換されたジエンが必要になります。
電子供与基は、アルキル基だと考えて問題ありません。
電子求引基には、クロロ基やトリフルオロメチル基のように誘起効果によるもののほかに、共鳴効果により電子受容体となれるカルボニル基やニトリル基を含むものも該当します。
ちなみに、反応後のシクロヘキセン誘導体は、アルキル基によって電子豊富なアルケンとなるため、さらにDiels-Alder反応が起こることはありません。
実際の反応例は、こちらです。
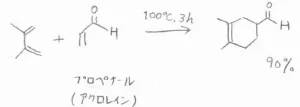
ブタジエンにメチル基を2つ付けて、エチレンにホルミル基を1つ付けると、収率は\(\displaystyle 90\%\)にまで上がります。
ただ、ブタジエンのほうには、特にアルキル基がなかったとしても、もとから電子豊富なので、アルケン次第ではとても速く反応が進行します。

エチレンからアクリル酸エチルに変えるだけで、収率は\(\displaystyle 94\%\)にまで上がります。
アルケンは、ジエンを好むという意味で、求ジエン体と呼ばれており、実際にはこちらに示したような化合物が該当します。
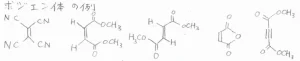
アルキンでも電子不足であれば、反応が起こる例があります。
フロンティア軌道理論
Diels-Alderの反応性については、分子軌道図を使って、次のように説明されます。

環を形成するすべての炭素原子は、反応前に\(\displaystyle \rm{sp}\)\(^2\)混成となっています。
平面に垂直な\(\displaystyle \rm{p}\)\(\)軌道どうしで相互作用することで、結合性軌道と反結合性軌道を作り出し、安定な状態を作り出します。
このとき、6つのうち4つの炭素原子は\(\displaystyle \rm{sp}\)\(^3\)混成に変わります。
ここで、分子軌道の位相に着目してみましょう。
ジエンとアルケンの間で結合性軌道を作るためには、ジエンの炭素原子2つと、アルケンの炭素原子2つで、位相がそろっていなければいけません。
2つのうち、一方しか位相が合わない場合は、環を形成できません。
これは、下図にあるようにジエンのHOMO(最高被占軌道)とアルケンのLUMO(最低空軌道)を考えることで実現可能です。

ここには書いていませんが、ジエンのLUMOとアルケンのHOMOでも、位相は同じになります。
一方の化合物のHOMOともう一方の化合物のLUMOだけが反応に関与すると考えると、対称なHOMOと反対称なLUMOの組み合わせになるエチレン2分子では、シクロブテンができないことを説明できます。
このような考え方をする理論をフロンティア軌道理論と言います。
すべての被占軌道が反応に関与すると考える有機電子論では説明が困難な事象も、フロンティア軌道なら説明できることがあります。
例えば、フロンティア軌道理論から、ジエンの両末端は求ジエン体の両方の炭素原子に同時に近づく機構であることがわかります。
そのためにジエンは、本来熱力学的に不安定であるs–cis型の立体配座をとる必要があります。
環状であるためにs–cis型の立体配座がとれないジエンは、不活性となります。
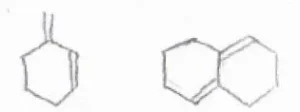
反対に、環状であることで、s-cis型に束縛されている場合は、反応が加速されます。

ただし、芳香族であるベンゼンやその誘導体は例外で、反応は起こりません。
反応は、協奏的に進行し、立体は保持されます。
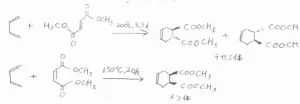
求ジエン体がフマル酸ジメチルなら、環化付加物はtrans体のみになります。
求ジエン体がマレイン酸ジメチルなら、環化付加物はcis体のみになります。
これは、ジエンについても同じで、ジエンがtrans,trans体ならば、環化付加物はcis体となります。
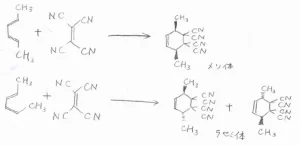
ジエンがcis,trans体ならば、環化付加物はtrans体となります。
ただし、これら反応前の物質はアキラルなので、生成物がキラルとなる場合は、ラセミ体として得られることになります。
エンド則
そして、Diels-Alder反応には、エンド則という法則があります。
例えば、シクロペンタジエンとマレイン酸ジメチルが反応する場合、下の2つの付加のしかたが考えられます。
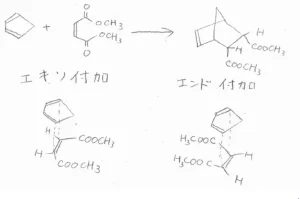
左をエキソ付加、右をエンド付加と言います。
一般的に、エキソ付加してできる生成物のほうが、嵩高い置換基がエクアトリアル位にくるため、立体反発が小さく、熱力学的には安定となります。
しかし、エンド付加する場合の遷移状態のほうが\(\displaystyle \pi\)軌道の重なりが大きく、少しだけ安定となるため、エンド付加体が選択的に多く生成することになります。
ただし、反応が可逆であるときや分子内でDiels-Alder反応が起こるときなどには、熱力学的にも安定なエキソ付加が優先される場合もあります。
電子環状反応
最後に、電子環状反応について、お話しして終わります。
これは共役ジエンや共役トリエン1分子内で起こる反応です。
ブタジエンに電子状態のエネルギー差に相当する波長の電磁波を照射すると、その緩和過程の1つとして、シクロブテンへの閉環が起こります。
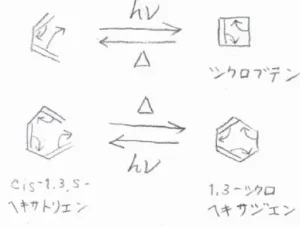
四員環の結合角ひずみは大きいので、この反応は吸熱反応です。
逆に開環する反応は、熱的過程によって起こすことができます。
反対に、cis-1,3,5-ヘキサトリエンの閉環は発熱反応で、熱的過程で起こります。
吸熱反応である1,3-シクロヘキサジエンの開環が光化学的過程で起こります。
電子環状反応と環化付加反応は、いずれもペリ環状反応と言われる一群の反応に属します。
ペリ環状反応とは、環状の遷移状態を経由して、\(\displaystyle \pi\)電子系を含む複数の結合が1段階で形成もしくは切断される反応の総称です。
Woodward-Hoffmann則
電子環状反応も協奏的、立体特異的に進行するので、置換基がある場合には、注意が必要です。
例えば、cis-3,4-ジメチルシクロブテンの熱的異性化は、cis,trans-2,4-ヘキサジエンのみを与えます。

さらに、この生成物に光を照射した場合に得られるのは、trans-3,4-ジメチルシクロブテンになります。
熱や光によって、どのように置換基が動くのかは、Woodward-Hoffmann則によって記述されます。

反応に関与する電子対数は、ジエンとシクロブテンで2、トリエンとシクロヘキサジエンで3となります。
これが偶数の系では、熱的過程で同旋的、光化学的過程で逆旋的となります。
同旋的とは、同じ方向に回るという意味で、逆旋的とは反対向きに回るという意味です。
電子対数が奇数の系では、熱的過程で逆旋的、光化学的過程で同旋的となります。
同旋的とは、図で書くと次のようなイメージです。
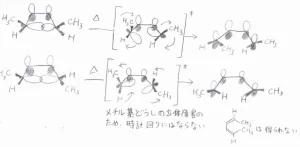
cis-3,4-ジメチルシクロブテンに熱をかけたとき、遷移状態では内部回転が起こることで結合の解離が起こります。
その回転の向きは、一方が時計回りならば、もう一方も時計回りとなり、cis,trans-2,4-ヘキサジエンが生成します。これが同旋的開環反応です。
反対に、一方が反時計回りならば、もう一方も反時計回りに回転しますが、生成物は同じです。
そして、trans-3,4-ジメチルシクロブテンに熱をかけた場合も、両方の内部回転は同じ方向になります。
ただし、両方が時計回りに回転すると、2つのメチル基の立体反発が生じるため、この場合は両方が反時計回りに回転します。
その結果、trans,trans-2,4-ヘキサジエンのみが生成します。
図にあるtrans-3,4-ジメチルシクロブテンのエナンチオマーを使った場合は、両方が時計回りに回転して、同じ化合物であるtrans,trans-2,4-ヘキサジエンが生成します。
いずれにしても、cis,cis-2,4-ヘキサジエンはほとんどできません。
一方、ブタジエン誘導体に光を照射した場合は、逆旋的に閉環反応が起こります。
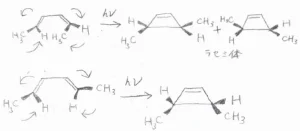
cis, trans-2,4-ヘキサジエンに光を照射すると、一方は時計回り、もう一方は反時計回りに回転して、trans-3,4-ジメチルシクロブテンが得られます。
特に回転の向きについては制約がないので、ラセミ体が得られます。
trans,trans-2,4-ヘキサジエンに光を照射した場合は、逆旋的な過程を経て、cis-3,4-ジメチルシクロブテンができます。
そして、共役トリエンの場合は、光化学的過程で同旋的開環反応、熱的過程で逆旋的閉環反応が起こります。
trans-5,6-ジメチル-1,3-シクロヘキサジエンに光を照射すると、trans,cis,trans-2,4,6-オクタトリエンが得られます。
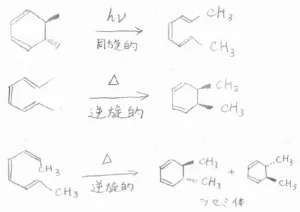
これに熱をかけると、cis-5,6-ジメチル-1,3-シクロヘキサジエンとなります。
cis,cis,trans-2,4,6-オクタトリエンに熱をかけると、trans-5,6-ジメチル-1,3-シクロヘキサジエンのラセミ混合物が得られます。
補足: 共役ジエンの重合
1つだけ補足ですが、ブタジエンやイソプレンなどの共役ジエンは、簡単に連鎖重合できるモノマーでもあります。
ポリイソプレンの重合様式が4つあることなどは、ゴムについてお話しした記事でお話ししているので、こちらを参照していただけたらと思います。

まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、X(https://X.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!