こんにちは!
それでは今日も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(benzene name)
ベンゼンの物性
まず、ベンゼンとは、分子式が\(\displaystyle \rm{C_6H}\)\(_6\)の化合物で、六員環の\(\displaystyle \pi\)電子共役系をもちます。
共鳴構造
このような共鳴構造をもっており、すべての炭素-炭素結合は等価になります。

一方の共鳴構造だけを書くこともあれば、六角形の中に円を描いて表すこともあります。
炭素-炭素結合の長さは\(\displaystyle 1.39\times 10^{-10}\ \rm{m}\)、炭素-水素結合の長さは\(\displaystyle 1.09\times 10^{-10}\ \rm{m}\)です。

炭素原子の外殻電子は\(\displaystyle \rm{sp}\)\(^2\)混成で、すべての炭素原子と水素原子の中心が同一平面上にあり、結合角もすべて\(\displaystyle 120^\circ\)です。
電子密度が大きい
その平面に対して、垂直な2方向に\(\displaystyle \rm{p}\)\(\)軌道が向いているため、非局在化した\(\displaystyle \pi\)電子の雲が形成されます。

これにより、一定の条件のもとでは、求電子剤との反応が起こります。
非常に安定
そして、ベンゼンは熱力学的にとても安定であることが知られています。
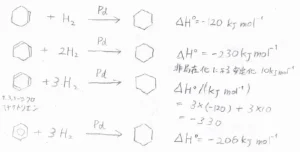
まず、シクロヘキセンの水素化熱が\(\displaystyle -120\ \rm{kJ\ mol}\)\(^{-1}\)、1,3-シクロヘキサジエンの水素化熱が\(\displaystyle -230\ \rm{kJ\ mol}\)\(^{-1}\)であることから、電子が非局在化するときには\(\displaystyle -230-(-120)×2\)で、\(\displaystyle 10\ \rm{kJ\ mol}\)\(^{-1}\)の安定化が起こることがわかります。
さらにもう1つ二重結合を増やして、1,3,5-シクロヘキサトリエンとした場合、水素化熱は\(\displaystyle -330\ \rm{kJ\ mol}\)\(^{-1}\)と理論上は計算されます。
しかし、実際のベンゼンの水素化熱は\(\displaystyle -206\ \rm{kJ\ mol}\)\(^{-1}\)で、単純な電子の非局在化では説明できないほど安定化が起こっていることになります。
ヒュッケル則と芳香族性
その効果は、環全体で\(\displaystyle \pi\)電子が非局在化していることに起因します。
どれくらい安定化するかは、実は、すでに量子力学の記事でお話ししています。

\(\displaystyle \pi\)電子共役系のエネルギー準位は、簡単にはヒュッケル法というテクニックで計算することができます。
芳香族、反芳香族、非芳香族
計算の結果、環状ポリエンには、電子の非局在化により安定となるものと不安定になるものがあることがわかります。
環状ポリエンとは、シクロブタジエンやベンゼンのように、二重結合を複数含む環状の炭化水素のことです。
電子の非局在化で安定となるものを芳香族、不安定となるものを反芳香族と言います。
原則、\(\displaystyle N\)を自然数として、\(\displaystyle \pi\)電子の数が\(\displaystyle 4N+2\)のときには芳香族、\(\displaystyle 4N\)のときに反芳香族となります。
この法則のことをヒュッケル則と言います。
ただし、そもそも非平面的な形状であるために電子が非局在化できないものは例外で、非芳香族と呼ばれます。
ここに示したのが、芳香族の例です。

共役した単環式の炭化水素の総称をアヌレンと呼びます。
小さいアヌレンについては、シクロブタジエンやベンゼンなどの呼び方が一般的ですが、炭素数が10を超えるような大きなアヌレンについては、炭素数\(\displaystyle n\)を頭に付けて、[\(\displaystyle n\)]アヌレンと呼びます。
芳香族に分類されるアヌレンでは、すべての炭素-炭素結合が同じ長さ、同じ強さになります。
対して、シクロブタジエンや[16]アヌレンは、反芳香族に分類されます。

電子の非局在化が有利ではないので、例えば、シクロブタジエンは正方形ではなく、長方形型の分子として観測されます。
これは、二重結合の長さが単結合に比べて短いためです。
電子の移動は、芳香族に比べるときわめて遅く、共鳴ではなく化学平衡の時間スケールで起こります。
そして、非芳香族には、こちらのような化合物が該当します。

まず、1,3-シクロペンタジエンや1,4-シクロヘキサジエンのように、\(\displaystyle \rm{sp}\)\(^3\)炭素を含んでおり、そもそも共役系ではない環状ポリエンはすべて非芳香族です。
また、アヌレンと言える化合物の中にも、結合角ひずみや立体障害が大きすぎるために、平面構造がとれないものがあります。
そうなると、電子が非局在化できないため、シクロオクタテトラエンや[10]アヌレンは、非芳香族に分類されます。
芳香族に含まれるイオン
この分類は、イオンにも当てはまります。

例えば、シクロペンタジエンからプロトンが1つ脱離してできるシクロペンタジエニルアニオンは、\(\displaystyle \pi\)電子が6個で、平面構造をもつため芳香族であり安定です。
そのため、シクロペンタジエンの\(\displaystyle \rm{p}\)\(K_\rm{a}\)\(\)はおよそ\(\displaystyle 16\)と、炭化水素にしてはとても高い酸性度を示すことになります。
また、シクロヘプタトリエンからヒドリドが脱離してできるシクロヘプタトリエニルカチオンも、芳香族になります。
シクロヘプタトリエンに臭素を加えて熱をかけると、臭化シクロヘプタトリエニルという安定な塩が得られます。
正電荷は7つの炭素原子上に等しく分布しており、カルボカチオンでありながら非常に安定で、反応性が著しく低いことが知られています。
また、\(\displaystyle \pi\)電子が4の倍数であるアヌレンは、電子を2つ失ってジカチオンになったり、逆に電子を2つ受け取ってジアニオンとなったりするものがあります。

下式に示したジカチオンやジアニオンは平面構造をもち、\(\displaystyle \pi\)電子が非局在化することによって安定化しています。
電子数の増減に伴って、立体構造が変化することがあります。
芳香族ヘテロ環化合物
そして、炭化水素ではなくても、芳香族となる化合物があります。

炭素原子と水素原子を除く原子のことをヘテロ原子と呼ぶので、これらの化合物は、芳香族ヘテロ環化合物と言います。
具体例としては、ピロールやフラン、チオフェン、ピリジンなどがあります。
芳香族的遷移状態
また、遷移状態で芳香族と同様の安定化が起こることで、進行する反応があります。
これまで当サイトで紹介してきた中では、Diels-Alder反応やオゾン分解、四酸化オスミウムによる隣接ジオールの合成などが挙げられます。

ベンゼン誘導体の名称
ここからは、ベンゼン誘導体を紹介していきます。
まず、一置換体は、ベンゼンの前にその置換基の名前を付けます。

二置換体以上の場合は、炭素の位置を数字で表すことで、ほかの位置異性体と区別して表します。

数字はなるべく小さくなるように付けます。
置換基はアルファベット順に並べて命名します。
また、二置換体に限り、オルト、メタ、パラという接頭語を付けることで、位置異性体を区別します。
ベンゼン誘導体には、慣用名をもつものがたくさんあります。

そして、ここに示した6つの化合物のように、上記の慣用名を使って、ほかの置換基についてのみIUPAC命名法を用いることがあります。
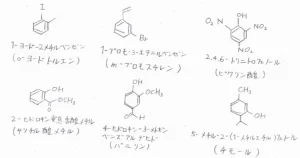
例えば、左上の化合物は、ベンゼンにメチル基とヨード基が付いているので、1-ヨード-2-メチルベンゼンというのがIUPAC名になります。
しかし、置換されたメチルベンゼンとして考えることで、o-ヨードトルエンと呼ぶこともできます。
芳香環をもつ部分を置換基として扱う場合もあります。
その置換基の総称をアリール基と言い、そのなかでベンゼンだけのもの、つまり\(\displaystyle -\rm{C_6H}\)\(_5\)のことをフェニル基と言います。
ベンジルアルコールだと、フェニルメタノールとなります。

ベンジル基とは、フェニルメチル基のことを指しています。
最後、複数のベンゼンが縮合してできる多環ベンゼン系と言われる化合物もあります。
これらは、多環芳香族炭化水素とも言います。

最も小さい例は、2つのベンゼン環が縮合してできるナフタレンです。
さらに、直線状にベンゼン環が増えていくと、アントラセン、テトラセンという慣用名になります。
直線状にベンゼン環が縮合してできる一連の炭化水素の総称は、アセンと言います。
縮合のしかたは一通りではなく、いちばん右にあるフェナントレンのような構造も考えられます。
直線状ではない縮環のことは、アンギュラー縮合と呼ばれています。
分光学的な特徴
ここからは、ベンゼンとその誘導体について分光学的な測定を行った場合、どのような結果が得られるのか、説明します。
¹H-NMR
始めに、¹H-NMRについて、お話しします。
ベンゼンの水素原子は強く反遮蔽化されており、化学シフトにして\(\displaystyle 7.72\ \rm{ppm}\)\(\)という値を示します。
すべて化学的に等価なので、ピークは1本だけです。
一般的なベンゼン誘導体の場合、ベンゼン環と結合している水素原子は、\(\displaystyle 6.5\sim 8.5\ \rm{ppm}\)\(\)くらいの化学シフトの値を示します。
反遮蔽化が起こる原理は、アルケンのときと似ています。

外部磁場をかけると、ベンゼン環上にある\(\displaystyle \pi\)電子によって、図中の赤色で示したような環電流が発生し、それにより青色で示した局部磁場が発生します。
その結果、ベンゼン環の中では遮蔽化が起こりますが、外側にある水素原子の周りでは、外部磁場と局部磁場が同じ方向に向いているため、原子核のスピン状態間エネルギーは大きくなります。
ただし、この効果はベンゼンから離れるにしたがって、急速に縮小していくため、ベンジル位にある水素原子についての化学シフトは\(\displaystyle 2\sim 2.5\ \rm{ppm}\)\(\)となり、アルカンからほんの少し反遮蔽化されているだけになります。
そして、ベンゼン誘導体については、アルケンやアルキンと同様、遠隔カップリングが起こります。
そのカップリング定数は、オルト水素間が\(\displaystyle 6\sim 9.5\ \rm{Hz}\)\(\)、メタ水素間が\(\displaystyle 1.2\sim 3.1\ \rm{Hz}\)\(\)、パラ水素間が\(\displaystyle 0.2\sim 1.5\ \rm{Hz}\)\(\)となっており、実際のスペクトルでは、オルトとメタのカップリングにより複雑な形のピークになります。
パラ水素間のカップリングは小さすぎて、分裂としてはよく見えませんが、ピークの幅が少しだけ広くなって見えることから存在を確認できます。
こちらが1-メトキシ-2,4-ジニトロベンゼンについての結果です。

まず、メトキシ基の水素原子に対応するピークは、化学シフトが\(\displaystyle 4\ \rm{ppm}\)\(\)くらいのところにきます。
そして、\(\displaystyle \rm{a}\)\(\)の水素原子については、オルトの位置に\(\displaystyle \rm{b}\)\(\)の水素があるので、大きく分裂した二重線が得られます。
次に、\(\displaystyle \rm{c}\)\(\)の水素原子については、メタの位置に\(\displaystyle \rm{b}\)\(\)の水素があるので、小さく分裂した二重線が得られます。
最後に、\(\displaystyle \rm{b}\)\(\)の水素原子については、オルトの位置に\(\displaystyle \rm{a}\)\(\)、メタの位置に\(\displaystyle \rm{c}\)\(\)の水素があるため、二重の二重線として観測されます。
また、ナフタレンの結果は、こちらのようになります。

化学的に等価な水素は2組あり、それぞれ4つずつになります。
ナフタレンでも反遮蔽化が起こるため、2つの化学シフトはどちらも\(\displaystyle 7\sim 8\ \rm{ppm}\)\(\)の間にきます。
オルトとメタ水素間のカップリングが主な要因となり、多重線が観測されます。
¹³C-NMR
続いて、¹³C-NMRについてお話しします。
外部磁場によって発生した環電流は、炭素原子上を回っているため、それによって発生する局部磁場による影響は、水素ほど大きくありません。
したがって、その化学シフトは、アルケンのものとほとんど変わらなくなります。

ナフタレンも、化学的に等価である炭素原子が3組あるので、ベンゼン誘導体と同じ領域に3つの共鳴線を示します。
IR
次に、赤外分光法について、見ていきます。
ベンゼンとその誘導体は、3つの領域に特徴的な吸収帯をもちます。

まず、\(\displaystyle 3030\ \rm{cm}\)\(^{-1}\)あたりにフェニル-水素伸縮振動があります。
そして、\(\displaystyle 1500\sim 2000\ \rm{cm}\)\(^{-1}\)の範囲に、芳香環の炭素-炭素伸縮振動の吸収帯があります。
3つ目は、\(\displaystyle 650\sim 1000\ \rm{cm}\)\(^{-1}\)に現れるフェニル-水素の面外変角振動の吸収です。
特に、この面外変角振動に対応する赤外線吸収では、それぞれの誘導体の置換様式によって、違いが現れることが知られています。

例えば、o-キシレンは\(\displaystyle 738 \rm{cm}\)\(^{-1}\)ですが、p-キシレンは\(\displaystyle 793\ \rm{cm}\)\(^{-1}\)となり、m-キシレンは\(\displaystyle 690\ \rm{cm}\)\(^{-1}\)と\(\displaystyle 765\ \rm{cm}\)\(^{-1}\)の2か所となります。
指紋領域なので、見にくいこともありますが、ここから位置異性体が予想できる可能性があります。
m-キシレンの実際のスペクトルは、こちらのようになります。

赤い丸で囲った部分が芳香族であることによって生じた吸収帯を表しています。
質量分析
続いて、厳密には分光法ではないですが、質量分析についてお話しします。
こちらに示したのが、ベンゼンの測定結果ですが、\(\displaystyle \frac{m}{z}=78\)の分子イオンピークがとても大きく出ており、顕著なフラグメント化が起こっていないことがわかります。

誘導体については、安定なベンジルカチオンやベンジルラジカルができるようなフラグメント化が起こることが考えられます。

2-フェニルエチルアミン(フェネチルアミン)の例だと、右のパターンがより多く起こって、\(\displaystyle \frac{m}{z}=30\)のピークが大きく見られることになります。
紫外分光法
最後に、紫外線の吸収について、お話しして終わります。
下の図は、3つの化合物について、横軸を吸収波長、縦軸をモル吸光係数の常用対数として示したものです。

黒がベンゼン、青がナフタレン、赤がtrans-1,3,5-ヘキサトリエンの結果です。
芳香族の\(\displaystyle \pi-\pi^\ast\)遷移に対応する吸収波長は、芳香族ではない共役トリエンのものに比べて、短くなります。
また、強度はかなり小さくなり、特徴的な微細構造を示すことがあります。
ベンゼンとナフタレンを比較すると、ナフタレンのほうが吸収波長が長くなっていることがわかります。
これは、井戸型ポテンシャルを考えたときに、箱が大きくなるほど、エネルギー準位の間隔が小さくなっていくことと同じイメージです。
詳しくは、以下の記事を参照してください。

さらに、アントラセンやテトラセンと長くしていくと、やがて可視領域の電磁波を吸収するようになって、色のついた物質として見えるようになります。
もっと長くしていくと、可視領域に複数の吸収波長をもつようになることで、黒っぽい色になっていきます。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、X(https://X.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!