こんにちは!
それでは今日も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(melting of mixture)
それでは内容に入っていきます!
非化合物系
まずは、今回考える系について簡単に説明します。
2つの成分\(\rm{A}\)と\(\rm{B}\)の混合系で、固相または液相を形成しているものとします。
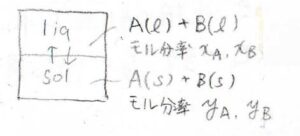
圧力は一定として、温度を変化させます。
液相の組成を\(x\)で表し、固相の組成を\(y\)で表すことにします。
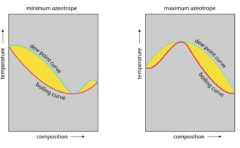
一般的に、この系についての温度-組成図は、このようになります。

青いところが液相の1相だけが存在している領域で、赤いところがほとんど\(\rm{B}\)の固相です。
緑のところがほとんど\(\rm{A}\)の固相です。
塗られていないところが相分離領域、RODです。
純粋なときに比べると、混合物の融点は低くなります。
これは、純粋なときに比べて液体のエントロピーが大きくなるためです。
いま、液体として存在できるもっとも低い温度を\(T_1\)とし、そのときの組成を\(e\)と表すことにします。
\(x_\rm{A}\)\(=e\)の液体を冷却していくと、温度が\(T_1\)のところで凝固して、2つの固相が形成されます。
もちろん、相図は熱力学的な状態を表した図であるため、経路に依存せず、固相全体の組成が\(e\)であれば、それは温度\(T_1\)で融解し、液相1相状態になります。
このように固相全体の組成と液相全体の組成が等しいまま起こる融解のことを共融と言います。
\(x_A=e\)の混合物のことを共融混合物といい、\(e\)のことを共融組成と言います。
この共融混合物が、すべて液体の状態から冷却していって、すべて固体になるまでの変化の経路を考えると、次のようになります。
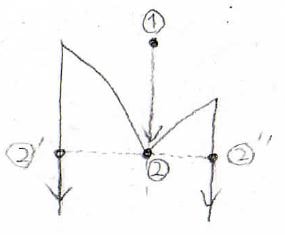
まず、点①から冷却していくと、真下の点②に到達します。
これよりも低い温度で液体は存在できないので、点②’と点②”という2つの固相の点に移ります。
液体がすべて固体になるまでは、温度が\(T_1\)で一定となります。
この現象を共融停止と言います。
共融混合物の例として、有名なものははんだ合金です。
これはスズと鉛を主成分とする合金です。
スズを約\(67\rm{wt\%}\)、鉛を約\(33\rm{wt\%}\)という割合で混ぜたときに、最も融点が低くなります。
用途によって、スズと鉛の割合を変えることで融点を調整することができます。
これにカドミウムやビスマス、インジウムなどを少量加えることもあります。
大気圧下では、純粋なスズの融点は\(231.9^\circ \rm{C}\)、純粋な鉛の融点は\(327.5^\circ \rm{C}\)ですが、上で示した割合で混合したはんだ合金の融点はおよそ\(183^\circ \rm{C}\)となります。

これにより、簡単に溶かして溶接することができます。
もうひとつ、有名なのが氷と食塩の組み合わせです。
水を\(77\rm{wt\%}\)、NaClを\(23\rm{wt\%}\)という割合で混ぜたときに、融点が最も低くなります。
その融点は\(-21.1^\circ \rm{C}\)です。
常温で、氷と食塩、そしてそれらが良く混ざるように液体の水も入れて放置しておくと、融点と気温の差が大きくなるため、純粋な氷よりも大気から多くの熱をうばって融解します。
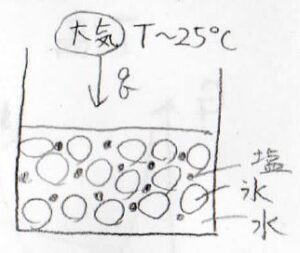
よく言われているように、ここに缶ビールを入れておくと、急速に冷やすことができます。
化合物系
それで、物質の組み合わせによっては、相図がもっと複雑になることがあります。
それは、2成分\(\rm{A}\)と\(\rm{B}\)が反応して新たな化合物\(\rm{C}\)ができる場合です。
調和融解
さらに、\(\rm{A}\)と\(\rm{C}\)、\(\rm{B}\)と\(\rm{C}\)の間で共融混合物もできるときには、相図はこのようになります。

ガリウム/ヒ素混合系が実際の例の1つで、ヒ化ガリウムの固相がモル分率\(0.5\)の組成で現れます。
固体のヒ化ガリウムを取り出して、それを融解させれば、ガリウムとヒ素が1:1で混合した液体を得ることができます。
このような融解のことを調和融解、もしくは一致融解と言います。
非調和融解
調和融解とは異なる非調和融解というものもあります。
実際の系では、ナトリウム/カリウム混合系がその例になります。
まず、調和融解であるとして、ある圧力における相図を書くと、下のようになります。
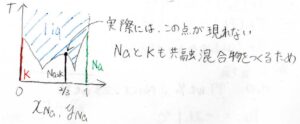
合金である\(\displaystyle \rm{Na_2K}\)の固相が形成されて、それらがカリウム、ナトリウムそれぞれと共融混合物を作ります。
しかし、現実では液相の凝固点を表す曲線に極大値が現れないという現象が起こります。
これは、ナトリウムとカリウムの間でも共融混合物を作るためです。
どういうことか、モルギブズエネルギーの温度変化から考えていきましょう。
まず低い温度の非化合物系について、横軸に\(\rm{A}\)のモル分率、縦軸にギブズエネルギーをとると、このようなグラフが書けます。
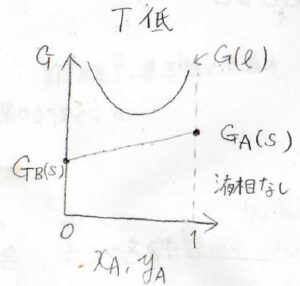
直線が固相全体のギブズエネルギー、曲線が液相のギブズエネルギーです。
あらゆる組成において、液相のギブズエネルギーより固相のギブズエネルギーが小さいので、液相の領域は存在しません。
温度が高くなると、どちらのギブズエネルギーも減少しますが、その変化量はエントロピーで決まるため、液相の方がより減少します。
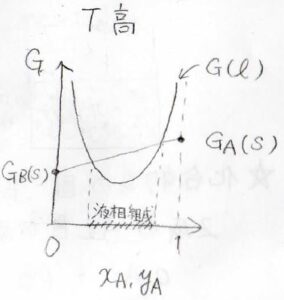
その結果、高温でこのように2つのギブズエネルギーが交わるようになります。
このとき、液相の値が固相の値を下回った領域は、液相の方が熱力学的に有利となります。
これを踏まえて、ナトリウム/カリウム系のギブズエネルギーを考えてみましょう。

まず、3つの成分の固相のギブズエネルギーを考えて、それらを直線で結びます。
さらに、温度が高いほど減少する曲線を考えます。
ここでは便宜上、固相のギブズエネルギーの温度変化を無視してグラフを書いています。
すると、最も低い温度に対応する青い曲線では、ナトリウムはそのままで、カリウムと\(\displaystyle \rm{Na_2K}\)の間で共融が起こるということになります。
しかし、さらに高い温度では、液相の曲線は、ナトリウムとカリウムの点を結んだ直線に交わるので、この間で共融が起こります。
すると、相図でカリウムと\(\displaystyle \rm{Na_2K}\)の共融は見えなくなります。
そのとき、温度-組成図はこのようになります。

温度によって、一方の曲線が隠れるので、折れ曲がった点が現れます。
また、化合物\(\displaystyle \rm{Na_2K}\)の固相と液相が繋がっていないという特徴があります。
\(\displaystyle \rm{Na_2K}\)の固相の温度を上げていくと、液相とナトリウムの固相が形成されて、そのいずれも化合物の組成とは一致しません。
このような融解を非調和融解と言います。
別名、分解融解とも言います。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!