こんにちは!
それでは今日も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(alkane)
それでは内容に入っていきます!
アルカンとは
まず、アルカンとは炭素原子と水素原子からなる化合物、すなわち炭化水素のうち、単結合のみで構成されるもののことを言います。
その中で、特に環を形成しているもののことは、シクロアルカンと呼ばれます。
炭素の個数に対応した名前があり、炭素の個数が1つのものをメタン、2つのものをエタン、3つのものをプロパン、4つのものをブタンと言います。
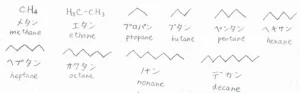
炭素数がとても大きいときには、高分子としてポリエチレンと呼びます。
これらの化学式は、\(\displaystyle n\)を自然数として、\(\displaystyle \rm{C}\)\(_n\rm{H}\)\(_{2n+2}\)という一般式で表すことができます。
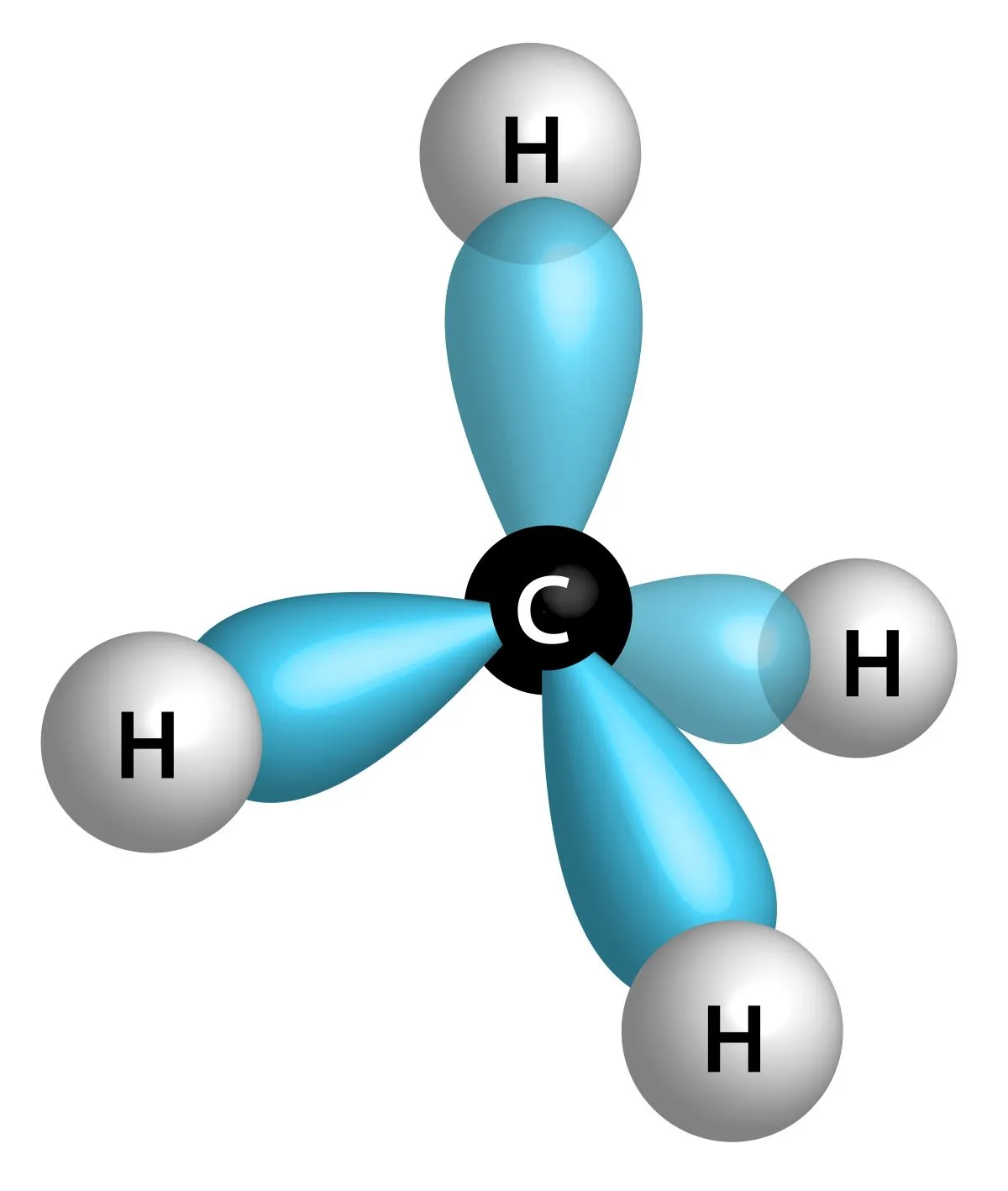
すべての炭素原子は\(\displaystyle \rm{sp}\)\(^3\)混成であり、安定な結合角はおよそ\(\displaystyle 109.5^\circ\)です。
シクロアルカンの場合は、その炭素数に対応したアルカンの名前の前に「シクロ」を付けて呼びます。
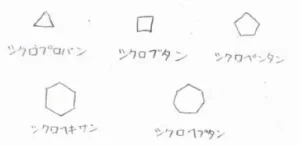
炭素が2個以下のときは環を形成できないので、最も小さなシクロアルカンはシクロプロパンです。
シクロアルカンの化学式の一般的な形は、\(\displaystyle n\)を自然数として、\(\displaystyle \rm{C}\)\(_n\rm{H}\)\(_{2n}\)となります。
前回もお話ししましたが、これらは\(\displaystyle \rm{sp}\)\(^3\)混成ではありますが、環を形成しているために、結合角にひずみが生じる場合があります。
これは、特に、炭素数の少ないシクロプロパンに顕著で、反応性にも大きく影響します。
命名法
そして、有機化合物の特徴として、分子式が同じでもその原子の配列や空間的な配置に違いが生じうるというものがあります。
同じ分子式で異なる構造をもつ化合物どうしを区別するためには、その化合物の呼び方が重要です。
ここからは、アルカンおよびシクロアルカン置換体の名前の付け方について、お話しします。
まず、有機化合物の名前は、慣用名と系統名の2種類に大別されます。
慣用名
慣用名とは、化合物が発見された当時に付けられた、古くからの呼び方です。
例えば、アリがもっている酸だからギ酸、お酢の酸だから酢酸といったように、慣用名からはその化合物の構造はわかりません。
また当然ですが、新しく見つかった、もしくはまだ見つかっていない化合物には慣用名がなく、むしろ慣用名をもつ化合物のほうが少ないです。
系統名(IUPAC名)
一方、系統名とは、あるルールに則って、化合物の構造を反映させて付けた名前です。
ギ酸は炭素数が1のカルボン酸だからメタン酸、酢酸は炭素数が2のカルボン酸だからエタン酸といった具合です。
そのルールを定めている国際純正・応用化学連合(IUPAC)からとって、IUPAC名と呼ぶことが一般的です。
このルールであれば、未知の化合物についても適用できます。
試験問題等で、化合物の構造が書かれていなければ、IUPAC名から構造を導く必要があるので、すべてのルールを暗記する必要はありませんが、ある程度は知っておかなくてはいけません。
まず、枝分かれのない直鎖アルカンについては、アルカン名の前に「n-」と付けて、ノルマルブタン、ノルマルヘキサンなどと呼びます。

炭素数が3以下の場合は、直鎖アルカンしか存在しえないため、わざわざ「n-」と付ける必要はありません。
そして、枝分かれがある場合については、まず最も長い炭素鎖に着目します。
それを主鎖として、そこに結合しているすべての短い炭素鎖をアルキル置換基として扱います。
アルキル置換基の呼び方は、alkaneの「ane」を「yl」に変えたものです。
さらに、その置換基が主鎖のどの炭素に結合しているかを表す数字も付けます。
例えば、こちらの化合物では、プロパンの末端から2番目の炭素にメチル基が結合しているので、2-メチルプロパンと呼ばれます。
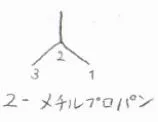
この化合物には、イソブタンという慣用名もあります。
アルキル基の前に付ける数字は、主鎖の2つある末端のどちらかを選択して数えたものなので、2通りの数え方が考えられますが、より数字が小さくなるほうを選択します。
例えば、こちらの化合物は、主鎖が炭素数7のヘプタンで、端から3番目の炭素にメチル基が結合しているので、3-メチルヘプタンとなります。
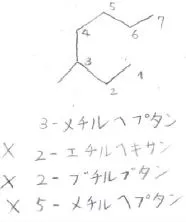
もう一方の端から数えて、5-メチルヘプタンとは言わないということです。
また、主鎖として短い炭素鎖を選択して、2-エチルヘキサンや2-ブチルブタンなどとしないように注意してください。
そして、複数の種類の置換基がある場合は、アルファベット順に若い方から読むというルールがあります。
例として、こちらの化合物では、まず主鎖は炭素数10のデカンになります。
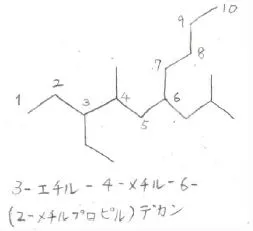
左側の末端から数えたほうが数字が小さくなるので、そのように数えます。
アルキル置換基は全部で3つありますが、エチル基の頭文字がEなのに対して、メチル基の頭文字はMで、Eのほうがアルファベット順で先にくるので、エチル基が冒頭にきます。
したがって、この化合物のIUPAC名は、3-エチル-4-メチル-6-(2-メチルプロピル)デカンとなります。
枝分かれをもつアルキル基は、主鎖と直接結合している炭素を1として、末端に向かって数えていきます。
また、その中には、慣用名をもっているものもあります。
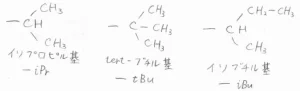
そして、同じ置換基を複数もっている場合は、その個数に応じた接頭辞を置換基の前に付けます。

メチル基やエチル基など、単純な置換基が2つあるものには「ジ」、3つあるものには「トリ」と付けます。
また、2-メチルプロピル基などのように複雑な置換基の場合には、2つあるときに「ビス」、3つあるときに「トリス」と付けます。
そして、シクロアルカン置換体についても、同様に命名のルールがあります。
主鎖に末端がないため、数字が最も小さくなるような炭素を1として数えます。
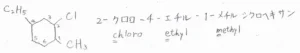
こちらの化合物の場合は、2-クロロ-4-エチル-1-メチルシクロヘキサンとなります。
クロロ基というのは、水素原子が塩素原子に置き換わったものを意味します。
そのほかのハロゲンの置換基は、フッ素はフルオロ基、臭素はブロモ基、ヨウ素はヨード基と言います。
アルファベット順に置換基を読むのは、先ほどのアルカンと同じです。
シクロアルカン置換体の特徴として、二置換体以上では、幾何異性体が存在する可能性があります。
例えば、こちらの2種類の1,2-ジメチルシクロブタンでは、一方のメチル基が紙面の手前側に向いているか、奥側に向いているかという違いがあります。
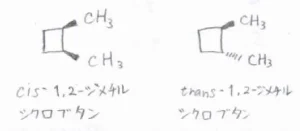
いくら内部回転しても両者の構造はぴったり重ならず、シクロブタン環を切断しなければいけません。
このように、結合している原子の配列はすべて同じで、回転が制限されている構造をもち、置換基の相対的な位置関係が異なるものを幾何異性体と呼びます。
置換基が同じほうを向いているものをシス体、反対へ向いているものをトランス体と呼びます。
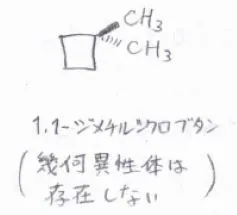
ただし、すべての多置換シクロアルカンに幾何異性体が存在しているというわけでもなく、例えば、1,1-ジメチルシクロブタンには幾何異性体がありません。
物理的性質
ここからは、アルカンの物性についての話をしていきます。
状態変化
こちらの表の中で、m.p.は\(\displaystyle 1\ \rm{atm}\)\(\)における融点、b.p.は沸点を表しています。
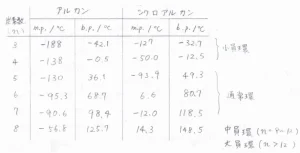
左側が直鎖アルカン、右側がシクロアルカンのデータです。
始めに、沸点について着目してみると、アルカンもシクロアルカンも炭素数が増えるのに伴って、沸点も上昇していきます。
一般的に、大きな分子ほど分子間ではたらく引力が大きくなるため液体が安定となり、沸点は上昇します。
さらに炭素数が増えてポリエチレンとなった場合には、沸点に至る前に分解が起こります。
つまり、焦げて黒くなるので、ポリエチレンは気体になることができません。
ポリエチレンに限らず、一般的に1万を超える分子量の高分子には、沸点が存在しません。
この傾向は、シクロアルカンでも同様です。
次に直鎖アルカンの融点について見ると、炭素数の増大に伴って、融点は上昇していることがわかります。
これは、分子間力が大きくなることで結晶がとても安定になることによるものです。
炭素数が3個以下のときには、結晶を形成したところで、分子間力がそこまで有利にはたらかないため、融点には大きな差がありません。
そして、最後にシクロアルカンの融点について見ると、炭素数の増大に伴って高くなっていく傾向はあるものの、炭素数が奇数のときには融点が低く、炭素数が偶数のときには融点が高くなっています。
これは、結晶を形成したときに、より対称性の大きな偶数炭素数の環のほうがより規則的で密な結晶構造を形成しやすい効果によるものです。
実は、同様の効果がアルカンでもはたらいており、炭素数が奇数から偶数になるときには、融点が\(\displaystyle 30\sim 40^\circ \rm{C}\)\(\)と大きく上昇しますが、偶数から奇数に替わるときには、融点の上昇は\(\displaystyle 10^\circ \rm{C}\)\(\)以下と極端に小さくなっています。
London分散力
ここで、分子間力について、補足をします。
炭素と水素は電気陰性度に大きな差がないため、通常、炭化水素は極性のない分子として扱われます。
しかし、分子内の電子の分布が一瞬だけ偏ることがあり、そうしてできる双極子は、さらに近くの分子の電子の分布を変化させ、図のように静電的な引力が発生することになります。
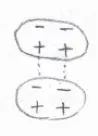
この力のことをLondon分散力と言います。
周囲の双極子によって、電子分布が変化することで生じる双極子のことは、誘起双極子と言います。
一般的に、大きな分子であるほど電子数が多いため、London分散力も大きくなります。
分子間で引力が強くはたらくときには、分子間距離の大小関係や運動性の違いから、気体よりも液体、液体よりも結晶のほうが大きく安定化されるため、融点や沸点は大きくなります。
また、同じ分子量の炭化水素を比べたときには、表面積が大きいほうが、よりLondon分散力が大きくなります。

これにより、イソペンタンよりn-ペンタンのほうが融点や沸点が高くなります。
ただし、結晶の形成については、分子の対称性も大きな影響を及ぼすため、表面積が小さかったとしても融点が直鎖アルカンより高いという場合があります。
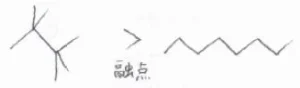
また、表面積が小さいということは、それだけコンパクトな形状であるということでもあるので、それにより分子間距離が小さくなれば、分子間引力が大きくなり、沸点の関係が逆転することもあります。
実際に、先ほどの表をもう一度見てみると、炭素数が5以上のアルカンとシクロアルカンを比較すると、同じ炭素数では、融点も沸点もシクロアルカンのほうが高いということになります。
これは、表面積から予想される結果と正反対です。
結合の強さ
次に、アルカンの熱分解から結合の強さを考えていきます。
燃焼が起こらないように酸素がない条件下で、アルカンを加熱すると、\(\displaystyle \rm{C-H}\)\(\)結合ならびに\(\displaystyle \rm{C-C}\)\(\)結合のホモリシス開裂が起こります。
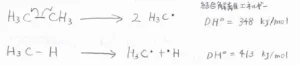
生じたラジカルは、ほかのラジカルと結合することで、元のアルカンとは、分子量も異なる新たなアルカンを生成します。
また、ラジカルは近くの他のラジカルから水素原子を引き抜くことで、二重結合をもつアルケンという化合物を与えることもあります。
そのため、構造の異なる複数の種類のアルカンとアルケンの複雑な混合物が得られることになります。
ただ、アルカンの結合の強さは、位置によって異なる場合があるため、実験条件をうまく選択することで、目的の炭化水素を高い収率で得られるように制御できる可能性があります。
結合の強さの評価には、結合解離エネルギーという値がよく用いられます。
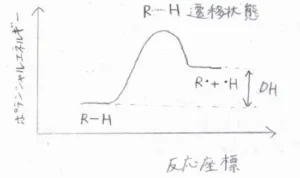
これは、標準温度、圧力において、2つの原子を結ぶある特定の化学結合をホモリシス開裂させるために必要なモルあたりのエネルギーとして定義されます。
結合解離エネルギーが大きいほど、その化学結合は強いと言えます。
ここでは、\(\displaystyle DH^\circ\)と表すことにします。
例として、エタンの\(\displaystyle \rm{C-C}\)\(\)結合の\(\displaystyle DH^\circ\)は\(\displaystyle 348\ \rm{kJ\ mol}\)\(^{-1}\)、メタンの\(\displaystyle \rm{C-H}\)\(\)結合の\(\displaystyle DH^\circ\)は\(\displaystyle 413\ \rm{kJ\ mol}\)\(^{-1}\)という値になります。
両者を比較すると、\(\displaystyle \rm{C-C}\)\(\)結合のほうが弱く、熱分解しやすいと言えます。
両者の違いは、主に結合距離による軌道の重なりの大きさで説明されます。
そして、一般的には、等級の高い炭素ラジカルができるような位置で、結合解離エネルギーは小さくなる、すなわち結合が弱いということが知られています。
炭素ラジカルの等級は、不対電子をもつ炭素原子にいくつのアルキル基が結合しているかで決まります。
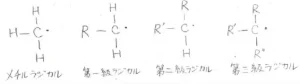
アルキル基が1つ結合していると第一級ラジカル、2つ結合していると第二級ラジカル、3つ結合していると第三級ラジカルとなります。
アルキル基が結合していないものは、メチルラジカルと言います。
そして、この法則によると、\(\displaystyle \rm{C-H}\)\(\)結合の強さはメタンが最も強く、イソブタンの2番目の炭素のように、立体的に混みあった部分に結合している水素原子ほど結合が弱く、熱分解しやすいということになります。
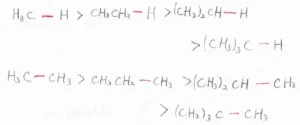
\(\displaystyle \rm{C-C}\)\(\)結合についても同じで、等級の高い炭素ラジカルができるような化学結合は比較的弱くなります。
炭素ラジカルの安定性
なぜそのようになるのかというと、等級の高いラジカルほど熱力学的に安定となるからです。
その理由を分子軌道から考えると、こちらの図を使って説明されます。
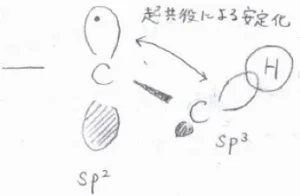
まず、不対電子が占有している軌道の隣にアルキル基の結合電子対がある形を想像してください。
アルキル基の炭素は\(\displaystyle \rm{sp}\)\(^3\)混成で、結合角はおよそ\(\displaystyle 109.5^\circ\)となるはずです。
そして、中心の炭素原子は\(\displaystyle \rm{sp}\)\(^2\)混成となります。
厳密には、不対電子がない場合に比べてひずんでいるとする本もあるそうですが、平面として扱って問題ありません。
不対電子が占有している原子軌道とそこに隣接しているアルキル基の結合電子対が占有している原子軌道は直交していないため、相互作用することができます。
具体的には、アルキル基から不対電子側へと電子が供与されることで、そのラジカルが熱力学的に安定となります。
この効果は超共役と呼ばれるもので、アルキル基が多いほど大きくなります。
結合解離エネルギーは解離後のポテンシャルエネルギーから解離前のポテンシャルエネルギーを引いた値であり、解離後の炭素ラジカルが安定であるほど、解離後のポテンシャルが低下するので、結合解離エネルギーは小さくなります。
内部回転と立体配座
続いて、アルカンの\(\displaystyle \rm{C-C}\)\(\)結合の回転について考えていきます。
アルカン
ここでは、n-ブタンを例にお話しします。
こちらの図に示されている矢印の方向からn-ブタンの分子を見ると、2位の炭素原子については、下方向へメチル基が向いており、3位の炭素原子については、上方向へとメチル基が向いている形に見えます。
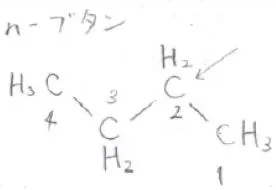
それを平面的に表現したものが下の図で、これをNewman投影式と言います。
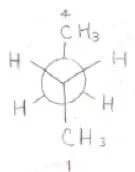
メチル基は、水素よりも嵩高いため、末端にあたる2つのメチル基が正反対の方向に向いているこの形がn-ブタンとしてもっともポテンシャルが低いことになります。
ただ、分子は絶えず熱運動しているため、すべての分子がこの形をとっていると考えるのは非現実的で、実際には分布をもつことになります。
2位の炭素原子と3位の炭素原子の間にある化学結合の内部回転角を横軸、ポテンシャルエネルギーを縦軸にとったグラフは、こちらの図のようになります。
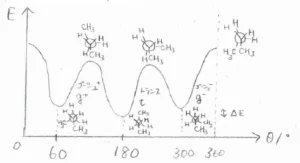
ポテンシャルが極小となる形は3つあり、先ほどの最も安定な形はトランスと呼ばれ、\(\displaystyle \rm{t}\)\(\)と表されます。
残る2つは、両末端のメチル基が互いに\(\displaystyle 60^\circ\)傾いた方向へ向いているもので、この形をゴーシュと言います。
時計回りと反時計回りがあるので、一方を\(\displaystyle \rm{g}\)\(^+\)、もう一方を\(\displaystyle \rm{g}\)\(^-\)と表記します。
これらのように、単結合の回転によって、互いに交換可能な空間的な原子の配置のことは、立体配座と言います。
これらが交換される過程では、ポテンシャルが極大となる点が存在しますが、そのとき2位の炭素原子と3位の炭素原子に結合しているそれぞれ3つずつの置換基が同じ方向を向いている立体配座となります。
これを重なり配座と呼びます。
通常、平衡状態にあるn-ブタンの立体配座の存在比は、ボルツマン分布に従います。
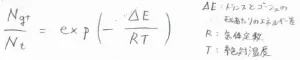
すなわち、トランスとゴーシュのモルあたりのエネルギー差を\(\displaystyle \Delta E\)としたとき、両者の存在比は\(\displaystyle \exp{(-\frac{\Delta E}{RT})}\)と表されます。
ここで、\(\displaystyle N\)は分子数、\(\displaystyle R\)は気体定数、\(\displaystyle T\)は絶対温度です。
ボルツマン分布については、こちらの記事を参照してください。

シクロアルカン
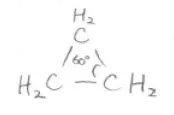
そして、シクロアルカンについては、環を形成する炭素原子がすべて同一平面上にあるとすると、重なり配座になってしまうため、不安定となります。
シクロプロパンは平面構造をとらざるを得ないため、重なりひずみを解消できません。
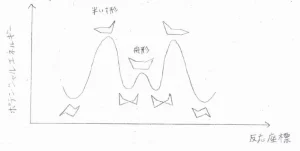
四員環以上であれば、平面構造をとらないようにすることで、よりポテンシャルの低い立体配座をとることができます。
それでも、すべての結合角ひずみと重なりひずみを同時に解消できることはありません。
ここには、ポテンシャルが極小となるような立体配座のみを示しています。

1,3-ジアキシアル相互作用
これは、シクロプロパンのポテンシャル図で、いす形からねじれ舟形への過程で半いす形、ねじれ舟形からもう一方のねじれ舟形への過程で舟形の立体配座を経由します。
ポテンシャルが対称な形になるのは、あくまでシクロヘキサンの場合の話で、より一般的に置換シクロヘキサンの場合は、2つのいす形立体配座間、ねじれ舟形立体配座間でエネルギーに差が生じます。
その主な理由は、1,3-ジアキシアル相互作用というものによるものです。
まず、こちらは、一方のいす形立体配座ですが、同じ炭素原子に結合している2つの水素原子のうち、片方だけが環の外側に向いている形になっています。
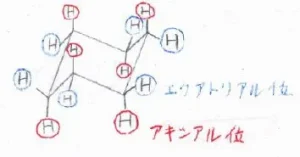
この位置のことをエクアトリアル位と言って、ここにある水素原子は、近くの炭素原子と結合している水素原子と重なっておらず、立体障害は小さいです。
しかし、もう一方の水素原子については、2つ隣の炭素原子に結合している水素原子と平行なほうへ向いているため、立体反発が生じます。
これが1,3-ジアキシアル相互作用です。
1,3というのは、2つ隣の炭素原子に結合している水素原子どうしで反発が起こるという意味です。
図中の赤い丸で囲んだ置換基の位置をアキシアル位と言うので、ジアキシアルとは、2つのアキシアル位にある置換基という意味です。
水素原子が嵩高い置換基になった場合には、さらに大きな立体反発が生じることになります。
一置換シクロヘキサンの場合は、その置換基がエクアトリアル位にくるいす形立体配座がもっとも安定です。
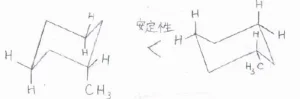
二置換シクロヘキサンでは、両方の置換基が同時にエクアトリアル位にある立体配座がとれれば、それが最安定となります。
必ず一方の置換基がアキシアル位にくる場合は、2つの置換基のうち、嵩高くないほうがアキシアル位にくる立体配座が最安定となります。

多環アルカンの幾何異性体の安定性
以上の話は、あくまで同一の化合物の異なる立体配座についての比較でしたが、環を複数もつ多環アルカンの場合は、幾何異性体の安定性に違いを生じさせます。
こちらは、六員環が2つ縮合したデカリンと呼ばれる化合物の幾何異性体です。
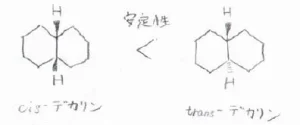
両者には、1位と6位の水素原子の立体配置に違いがあり、trans-デカリンのほうがcis-デカリンよりも熱力学的に安定であることが知られています。
両者の最安定な立体配座は、こちらのとおりです。
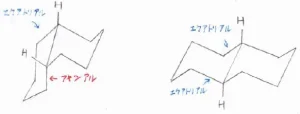
一方の六員環はシクロヘキサンと同様のいす形立体配座をとっており、もう一方の六員環は2つのアルキル基と考えてください。
そうすると、trans-デカリンでは、2つのアルキル基が同時にエクアトリアル位にあるような立体配座をとれるのに対して、cis-デカリンでは、必ず一方のアルキル基がアキシアル位にくることがわかります。
1,3-ジアキシアル相互作用を解消できない分、cis-デカリンはtrans-デカリンよりも熱力学的に不安定となります。
ラジカル連鎖機構で起こるハロゲン化
最後に、アルカンで起こる化学反応を1つ紹介して終わります。
そもそもアルカンは、分極はほとんどなく、結合もある程度強く、空軌道も孤立電子対もないので、反応性が高い化合物ではありません。
起こりうる反応と言えば、燃焼、熱分解、異性化と数えるほどしかありません。
ここで紹介するのは、ラジカル連鎖機構によるハロゲン化と言われる反応です。
例えば、プロパンに塩素ガスを混ぜて、そこに紫外線を照射するか\(\displaystyle 300^\circ \rm{C}\)\(\)以上に加熱すると、水素原子が塩素原子に置換されて、1-クロロプロパンと2-クロロプロパンの混合物が得られます。
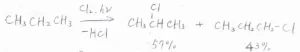
また、同時に塩化水素も生成します。
これは、複数回の遷移状態を経由する多段階の反応です。
全体では発熱反応ですが、その中に活性化エネルギーが大きい素反応があるので、常温の暗所ではこの反応は起こらず、光や熱をきっかけに反応が進行します。
クロロ化の各ステップは、次のような反応です。
まず塩素分子が光や熱によってホモリシス開裂し、ラジカルである塩素原子が生成します。

\(\displaystyle \rm{Cl-Cl}\)\(\)結合の結合解離エネルギーは\(\displaystyle 243\ \rm{kJ\ mol}\)\(^{-1}\)で、\(\displaystyle \rm{C-H}\)\(\)結合や\(\displaystyle \rm{C-C}\)結合よりも弱いので、炭素ラジカルよりも発生しやすいです。
この塩素原子が活性な化学種として、次の段階の反応を起こしていくことになるので、その最初の段階の反応ということで、これを開始反応と言います。
次の段階で、ラジカルである塩素原子は、アルカンから水素原子を引き抜くことで塩化水素が生成すると同時に炭素ラジカルが生成します。
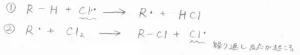
発生した炭素ラジカルが塩素分子から一方の塩素原子を引き抜くことで、水素原子から塩素原子への置換体となります。
それと同時にできた塩素原子は、1つ前の段階の反応物として、再び炭素ラジカルを発生させることになります。
このようにして、反応がさらに次の反応を起こしていくため、これら2つの素反応をまとめて、伝搬段階と呼びます。
次の段階は、ラジカルが消失して反応が終了する停止反応と呼ばれるものです。
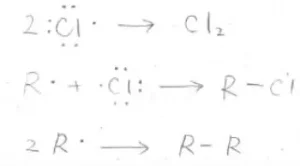
2つのラジカルが接近したときに化学結合をつくることで、ラジカルは消失します。
2つのラジカルの組み合わせは、塩素原子どうし、炭素ラジカルどうし、塩素原子と炭素ラジカルのパターンが考えられます。
この一連の反応機構のことをラジカル連鎖機構と言います。
ビニル化合物のラジカル重合もラジカル連鎖機構によって起こるので、高分子を専攻する人は、よく見ることになると思います。
そして、生成物であるハロアルカンについて、どこの炭素原子上の水素原子が置換されやすいかというのは、アルカンとハロゲン分子の両方に依存します。
こちらの表は、アルカンとハロゲンの組み合わせと、そのときに1つの水素原子が置換される相対的な反応性を表しています。

反応条件は、いずれも圧力が\(\displaystyle 1\ \rm{atm}\)\(\)で、温度が、フッ素と塩素について\(\displaystyle 25^\circ \rm{C}\)\(\)、臭素については\(\displaystyle 150^\circ \rm{C}\)\(\)のときの値です。
それぞれのハロゲンについて、第一級の\(\displaystyle \rm{C-H}\)\(\)結合1つ分の反応性を\(\displaystyle 1\)としているので、横に並んだ数字どうしの比較は意味をもちません。
縦に並んだ数字どうしで比較すると、まず、中間体である炭素ラジカルの安定性により、表の下にいくほど反応性が大きくなっています。
ただし、フッ素はどのアルカンともある程度反応するのに対して、臭素はかなり選択的に第三級の\(\displaystyle \rm{C-H}\)\(\)結合で反応が進行します。
実際の収量の比は、この表の値に該当する水素原子の個数をかけたものになります。
そして実は、ここに書かれていないヨウ素については、反応が進行しません。
その理由は、伝搬段階の1つ目の反応がとても吸熱的なために、反応全体でも吸熱的になるからです。
実際の反応例は、次のとおりです。
まず、2-メチルプロパンにフッ素を反応させた場合、第一級水素が置換されたものの相対的な収量は、先ほどの表にあった反応性\(\displaystyle 1\)と水素原子の個数\(\displaystyle 9\)との積で、\(\displaystyle 9\)となります。
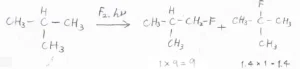
それに対して、第三級水素が置換されたものの収量は、反応性\(\displaystyle 1.4\)と水素の個数\(\displaystyle 1\)との積で、\(\displaystyle 1.4\)となります。
フッ素への置換反応では、水素原子の位置の違いによる反応性に大きな差がないので、ほとんど水素原子の個数比によって、相対的な収量が決まります。
一方で、塩素を反応させた場合には、第一級と第三級の収量の比が\(\displaystyle 9:5\)となり、どちらもある程度ずつ混ざった混合物が得られることになります。
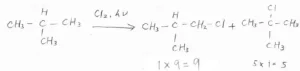
臭素を反応させた場合には、第一級と第三級の収量の比が\(\displaystyle 9:1700\)となり、ほとんど第三級水素しか置換されないことになります。
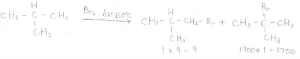
この選択性の違いは、伝搬段階の1つ目の反応、すなわちアルカンから水素原子が引き抜かれて、炭素ラジカルとハロゲン化水素できる過程のポテンシャル図から説明されます。
まず、フッ素についてですが、\(\displaystyle \rm{C-H}\)\(\)結合は\(\displaystyle \rm{H-F}\)\(\)結合に比べて結合解離エネルギーが\(\displaystyle 130\sim 160\ \rm{kJ\ mol}\)\(^{-1}\)ぐらい小さい、すなわち弱い結合です。
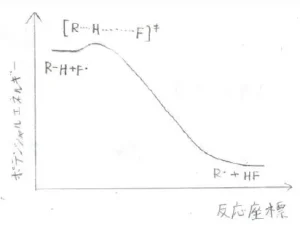
\(\displaystyle \rm{C-H}\)\(\)結合を切断して、\(\displaystyle \rm{H-F}\)\(\)結合を形成するためには、\(\displaystyle \rm{C-H}\)\(\)結合をほんの少し伸ばしてフッ素原子に近づけるだけで十分です。
したがって、遷移状態の構造は反応物と大差なく、活性化エネルギーは小さく、反応はとても速く進行します。
一方で、臭素の場合は\(\displaystyle \rm{H-Br}\)\(\)結合がそこまで強くないので、結合を形成するためには、もっと水素原子を臭素原子のところまでもっていかないと、アルカンへ戻ってしまいます。
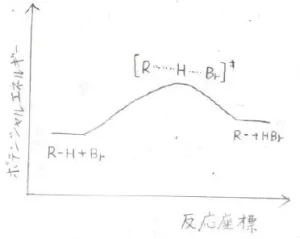
遷移状態の構造は、生成系に近くなると同時に、活性化エネルギーも増大し、反応速度も遅くなります。
以上のことを整理すると、まず、反応によって大きな熱が放出される反応ほど、反応座標の早い段階で遷移状態に到達します。
反応系と遷移状態で構造の差が小さいということは、活性化エネルギーが小さいことを意味するため、反応は速く進行します。
反対に、反応が吸熱的であるほど、遷移状態に到達するまでが遅いので、活性化エネルギーは大きく、反応は遅く進行します。
この2つの規則のことは、Hammondの仮説として知られているものです。
フッ素への置換の位置選択性が低いのは、どこの炭素に結合していた水素原子でも活性化エネルギーに大きな差がなく、すぐに反応してしまうためです。
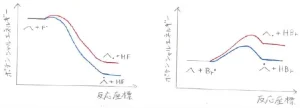
臭素の場合、遷移状態は生成系と似た構造をとるため、より安定な炭素ラジカルができる第三級水素の引き抜きが活性化エネルギーも低く、速く進行するため、高い位置選択性が現れます。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、X(https://X.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!