こんにちは!
それでは今日も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓

動画で使ったシートはこちら(alcohol 1、alcohol 2、alcohol 3、alcohol 4)
アルコールの命名法
IUPACでのアルコールの名前は、今からお話しするルールに則って付けられます。
アルカンのaneをolに変える
炭素数が同じアルカンのaneをolに変えることで、アルコール名にします。
例えば、メタンならメタノール、エタンならエタノールとなります。
ヒドロキシ基に近い炭素末端を1とする
例えば、下のアルコールは3-オクタノールであり、6-オクタノールではありません。
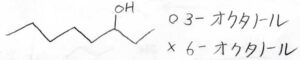
頭につく数字は、なるべく小さくなるようにします。
環状アルコールヒドロキシ基が付いた炭素を1とする
シクロアルカンの水素原子が1つヒドロキシ基に置換されたものは、シクロアルカノールと呼ばれます。
その命名法は、ヒドロキシ基がついた炭素原子を1として。他の置換基の場所を表します。
図の化合物であれば、2-メチルシクロヘキサノールと言います。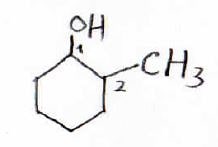
アルコールの物性
\(\displaystyle \rm{C-O-H}\)の結合角は\(109.5^\circ\)に近い値
酸素原子の周りで見ると、共有結合2本と孤立電子対2対の計4つの電子軌道が、\(\displaystyle \rm{sp}\)\(^3\)混成軌道の正四面体型の配置で静電反発を避けようとします。
アルキル基の立体障害や孤立電子対間の静電反発の影響で、\(109.5^\circ\)ちょうどにはなりませんが、それに近い(メタノールで\(\displaystyle 108.9^\circ\))折れ線型の構造となります。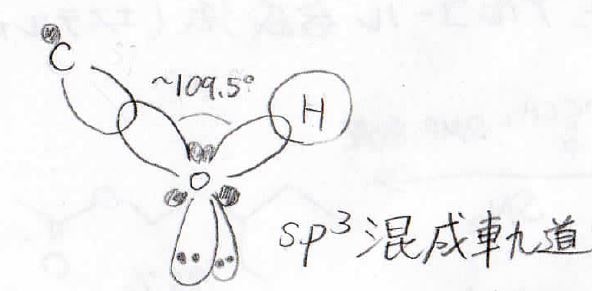
\(\displaystyle \rm{O-H}\)結合の長さは\(\displaystyle \rm{C-H}\)結合より短く、結合エネルギーが大きい
酸素原子の大きい電気陰性度により電子が引き付けられるため、結合距離が短くなり、結合エネルギーは大きくなります。

分子全体で双極子をもつ
酸素原子の電気陰性度のために双極子ができ、折れ線型ではそれらが打消し合うことができないので分子全体で双極子をもつことになります。
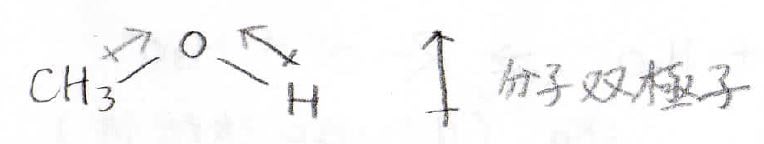
沸点が高い
この表はメタンとメタノール、エタンとエタノールの沸点を比較したものです。
水素がヒドロキシ基になっただけですが、これにより分子間で水素結合による安定化が起こるので、アルコールは液体であろうとします。
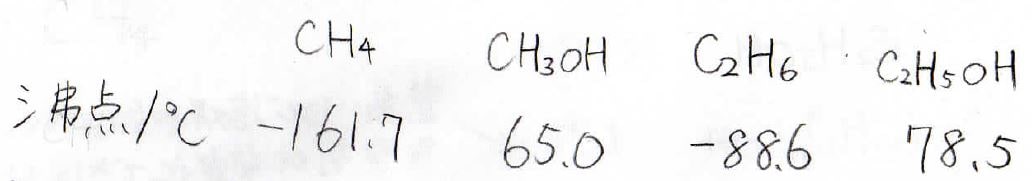
水への溶解性
エタノールのような低分子量のアルコールは水とよく混じります。
常温でもメタノール、エタノール、1-プロパノールは水と混和するので、溶解度は無限大といえます。
これに対して、1-ペンタノールは\(23^\circ \rm{C}\)で\(100\ \rm{mL}\)の水に\(2.2\ \rm{g}\)しか溶けません。
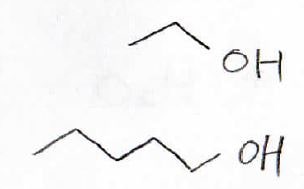
これは、アルキル基の疎水性が原因です。
\(\displaystyle \rm{C-H}\)間は電気陰性度の差が小さく極性がほぼないため、これが水素結合で安定化した系に入ると、水素結合が一部形成できなくなり、エンタルピーが上昇します。
また、アルキル基同士でLondon力による自己集合が起こるため、アルキル基が長くなるほどその傾向が顕著になり、水と混ざらなくなります。
酸、塩基両方の性質を持つ
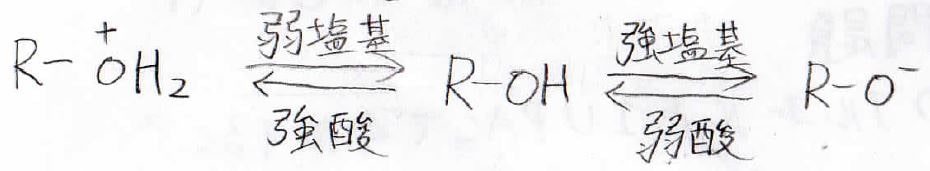
この表は、水といくつかのアルコールについてその\(\rm{p}K_\rm{a}\)を書いたものです。
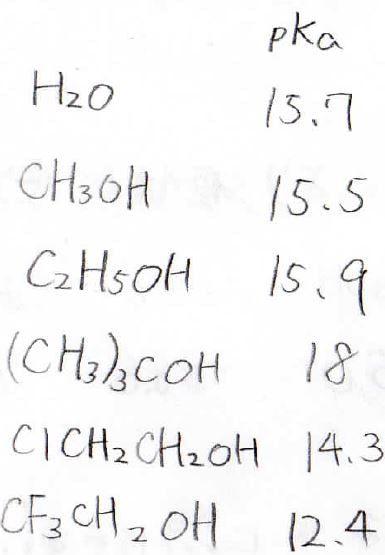
\(\rm{p}K_\rm{a}\)の定義は\(-\log{K_\mathrm{a}}\) (\(K_\mathrm{a}\)は酸解離定数)で、この値が小さいほど強い酸ということになります。
水でもアルコールでも\(\displaystyle \rm{O-H}\)間で電気陰性度の違いにより分極が起こるので、水素はプロトン性になります。
そのため、水、メタノール、エタノールは似たような\(\mathrm{p}K_\mathrm{a}\)の値をもちます。
嵩高いアルコールは溶媒和による安定化が起こりにくいので、イオンとして存在しにくいです。
そのため、\(\rm{p}\)\(K_\rm{a}\)は増大し、酸としては弱くなります。
アルキル部分にハロゲンなど電子求引基がついている場合は、水素の周りの電子密度が余計に小さくなるため、\(\rm{p}K_\rm{a}\)は減少し、酸性度は上がります。
この効果は誘起効果と呼ばれます。
続いて、塩基としてのアルコールの比較をしていきます。

酸素原子上に孤立電子対があることで、アルコールはプロトンを引き抜くことができます。
共役酸の\(\mathrm{p}K_\mathrm{a}\)はここに示したとおりで、溶媒和で予測されるように、高級アルコールほど弱塩基になります。

このように、水やアルコールのように酸としても塩基としてもはたらくことは、両性であるという言います。
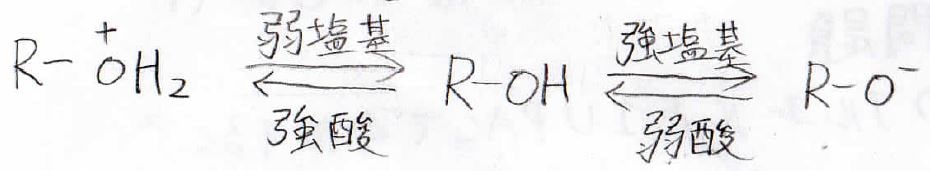
工業的製造法
まず、メタノールは一酸化炭素と水素を下記の金属触媒のもとで、高温高圧下で反応させることで得られます。
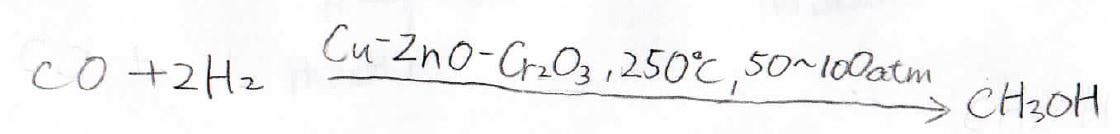
似たような方法で1,2-エタンジオール(エチレングリコール)も作られます。
これは、エンジンの不凍液に用いられることで有名な化合物です。
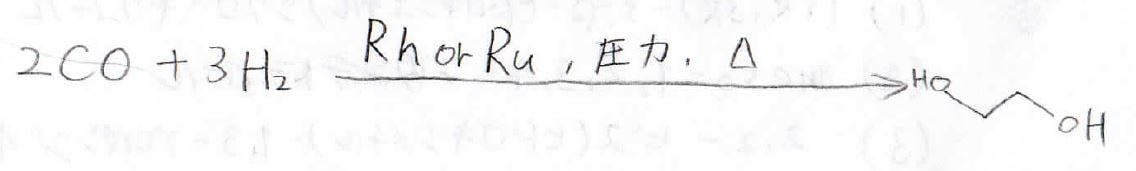
エタノールは、エチレンにリン酸を触媒として水を付加させることで得られます。
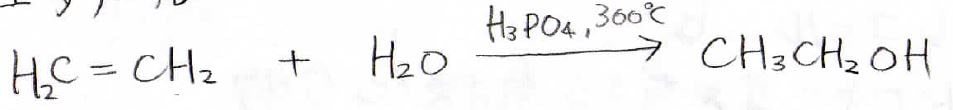
また、でんぷんなどの糖類を微生物によって発酵させることでも作れます。
これがいわゆるお酒です。
求核置換反応による合成
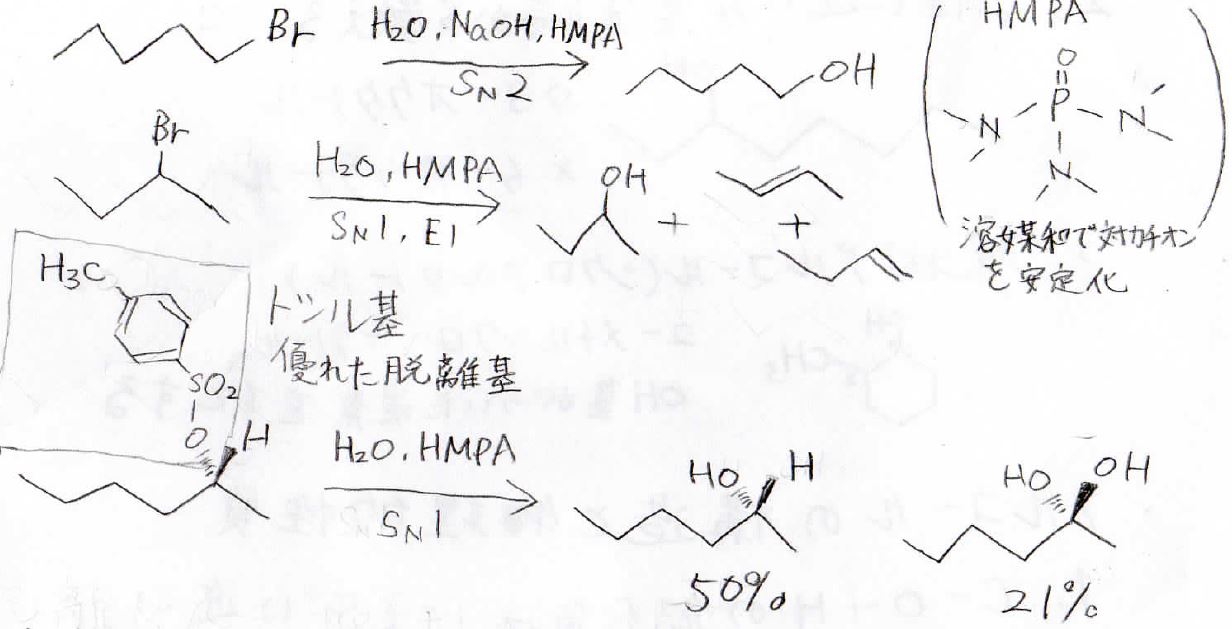
脱離基をもつ基質に水酸化物イオンまたは水を求核攻撃させることでも、アルコールが得られます。
\(\displaystyle \rm{S_N}\)\(2\)機構で反応が進行すれば純度の高い生成物が得られますが、実際のところは、\(\displaystyle \rm{S_N}\)\(1\)や\(\displaystyle \rm{E}\)\(1\)、\(\displaystyle \rm{E2}\)も起こります。
その結果、何種類かのアルコールが得られたり、アルケンができたりとなかなか扱いにくい反応なので、さほど多くは使われていないアルコール合成法です。
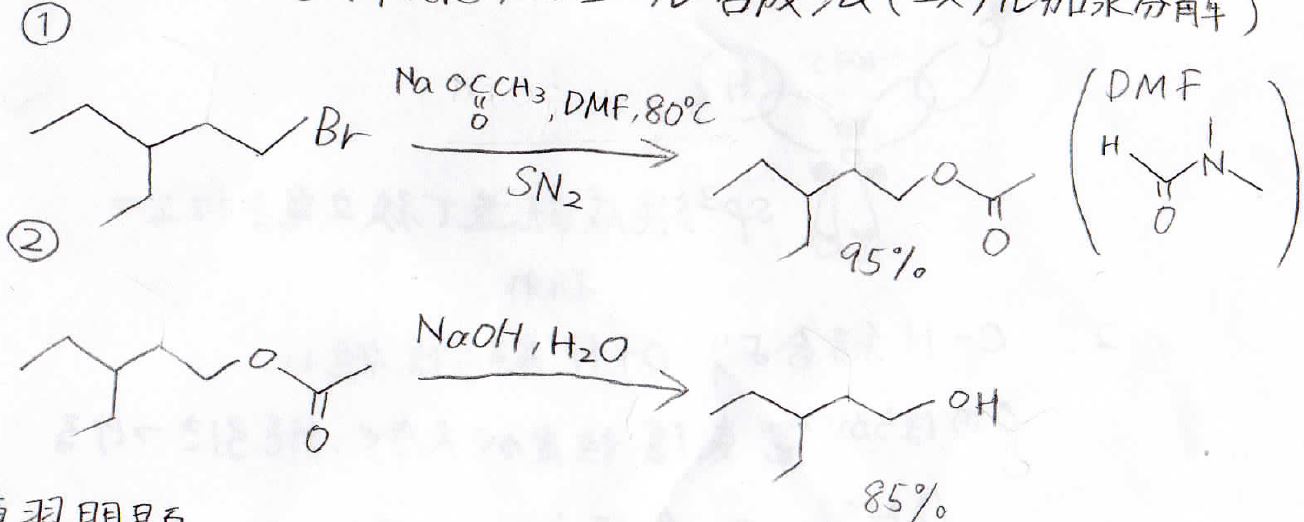
エステル加水分解
酢酸イオンという弱塩基を使うことで、脱離反応は抑えることができます。
基質に求核攻撃させてエステルとした後、これを塩基触媒で加水分解してアルコールにします。
この加水分解は酸触媒でも進みますが、塩基触媒のほうが反応速度が速いです。
アルコールの酸化、還元
酸化、還元とは
酸化のパターンは次の3つです。
- ハロゲンや酸素など陰性原子が付加する
- 水素が奪われる
- 電子を失う
そして、還元は酸化の逆です。
- 酸素などが外れる
- 水素が付加する
- 電子を受け取る
下図は、メタンが酸化されて二酸化炭素になるまでの経路ですが、その間にはアルコール、アルデヒド、カルボン酸があります。
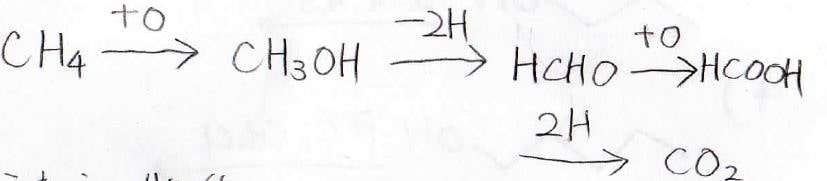
酸素が付くか、水素が外れるかの2パターンのみで、これら5つの化合物の関係を結び付けることができます。
アルコールの還元
先ほどのメタンから二酸化炭素までの関係を見ると、アルコールはアルデヒドの還元によりできるということがわかります。
また、ケトンを還元してもアルコールになります。
アルデヒドやケトンの\(\displaystyle \rm{C=O}\)二重結合の部分はカルボニルと呼ばれますが、カルボニルでは炭素が正、酸素が負に分極しています。
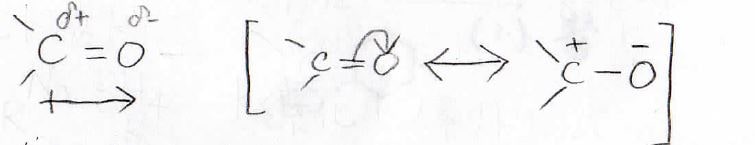
これはそもそも電気陰性度の差があることに加えて、このような共鳴構造の寄与があるからです。
もしカルボニルにヒドリド\(\displaystyle \rm{H}\)\(^-\)を加えた場合は、正に帯電しているカルボニル炭素に求核攻撃して、アルコキシドアニオンが生成します。
あとは、これを水で処理すればアルコールになります。
これはヒドリドを使った還元なので、ヒドリド還元と言います。
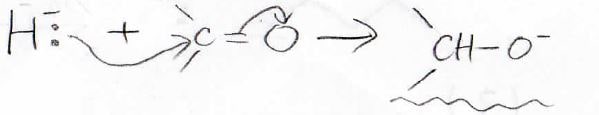
ヒドリド還元に使う反応剤は、少し変わったものを使います。
ヒドリドをもつ試薬として最初に思いつくのは、水素化ナトリウムや水素化リチウムかと思いますが、これらは水やアルコールなどのプロトン性溶媒と激しく反応してしまいます。
さらに、有機溶媒への溶解度が悪いので、使い勝手がよくありません。
そこで、実際のヒドリド還元には、次のような試薬を使います。
1つが水素化ホウ素ナトリウム\(\displaystyle \rm{NaBH_4}\)、もう1つは水素化アルミニウムリチウム\(\displaystyle \rm{LiAlH_4}\)です。
それぞれ、略称でSodium BorohydrideのSBHと、Lithium Aluminium HydrideのLAHと呼ばれることもあります。
これらは有機溶媒との親和性が高く、またプロトン性溶媒との反応も比較的穏やかです。
この2つでは\(\displaystyle \rm{NaBH_4}\)のほうがより反応性が低く、こちらはプロトン性のエタノールでも溶媒として使うことができます。
\(\displaystyle \rm{LiAlH_4}\)はエタノールと反応して水素が発生してしまうので、非プロトン性であるジエチルエーテルなどが溶媒として一般的です。
実際の反応例は、下記のとおりです。
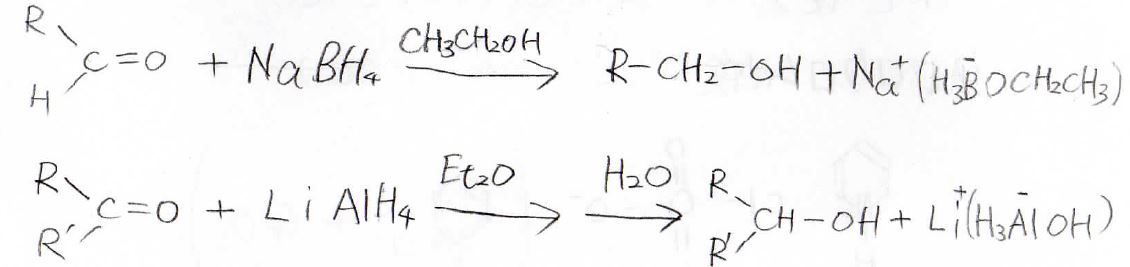
\(\displaystyle \rm{LiAlH_4}\)の場合は反応が終わった後で、水の処理が必要なので、覚えておいてください。
アルコールの酸化
続いて、酸化の話をします。
アルコールを酸化させると、アルデヒドやカルボン酸となります。
その酸化剤には、\(\displaystyle \rm{Cr}\)\((\rm{VI}\)\()\)を含む試薬が用いられます。
酸化剤の例としては、ニクロム酸ナトリウム\(\displaystyle \rm{Na_2Cr_2O_7}\)、ニクロム酸カリウム\(\displaystyle \rm{K_2Cr_2O_7}\)、酸化クロム\(\displaystyle \rm{CrO_3}\)があります。
\(\displaystyle \rm{Cr(VI)}\)自身は、還元されることで最終的に\(\displaystyle \rm{Cr(III)}\)になります。
反応の前後で色が 黄橙色から深緑色になるので、反応の進行を目で確かめることができます。

実際の反応系の中で酸化剤としてはたらくのは、ニクロム酸\(\displaystyle \rm{H_2Cr_2O_7}\)であるため、この酸化反応は酸性条件下で行います。
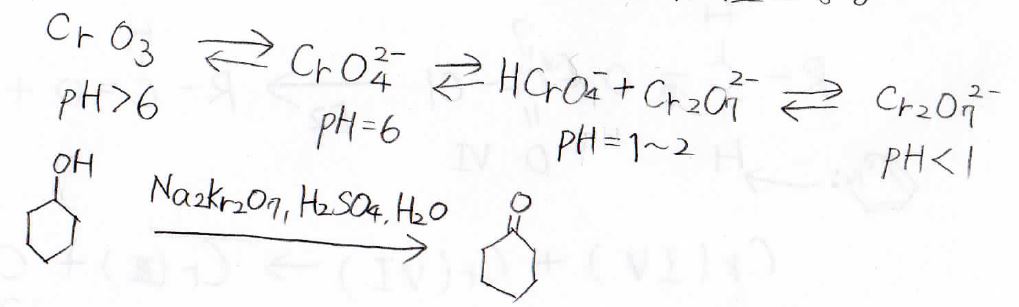
実際の反応例は上記のとおりで、第二級アルコールからはケトンが生成します。
しかし、第一級アルコールにニクロム酸カリウムと希硫酸を加えた場合は、アルデヒドではなくカルボン酸になります。
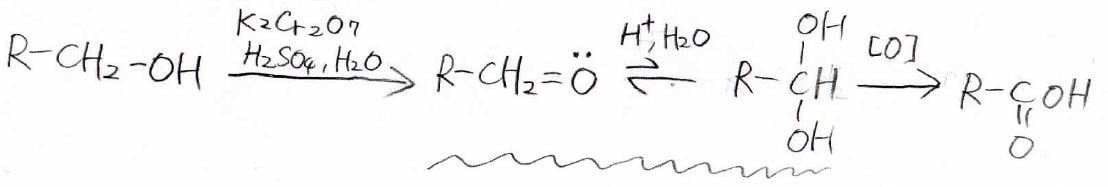
一旦は水を介してアルデヒドとジェミナルジオールの化学平衡になるのですが、ジェミナルジオールがさらに酸化剤によって過剰酸化されてしまうので、アルデヒドはほとんど得ることができません。
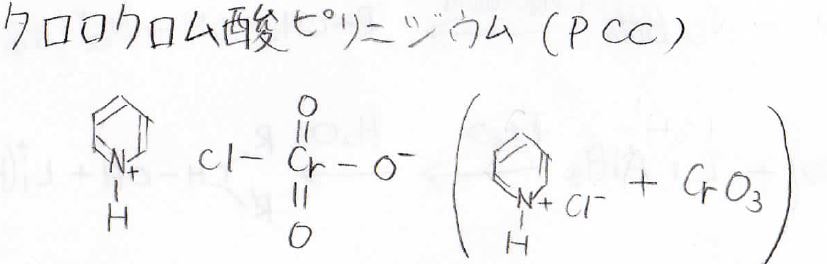
そこで、第一級アルコールからアルデヒドを得るためには、クロロクロム酸ピリニジウム、通称PCCと呼ばれる試薬を使います。
この試薬は、ピリジンと塩化水素から作った塩化ピリニジウムに酸化クロム\(\displaystyle \rm{CrO_3}\)を加えて作ります。
溶媒にはジクロロメタンを使うのが一般的で、このように第一級アルコールからアルデヒドを作ることができます。
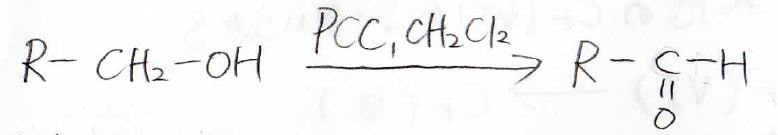
この酸化反応の機構は下記のとおりで、アルコールとクロム酸が反応した後、\(\displaystyle \rm{E2}\)機構で\(\displaystyle \rm{C=O}\)二重結合が形成されます。
このとき、\(\displaystyle \rm{Cr}\)の価数は、\(\displaystyle \rm{VI}\)から\(\displaystyle \rm{IV}\)になります。
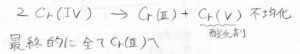
その後、\(\displaystyle \rm{Cr(IV)}\)どうしで電子のやり取り(これも酸化、還元)をすることで\(\displaystyle \rm{Cr(III)}\)と\(\displaystyle \rm{Cr(V)}\)が生まれます。
この過程は、不均化と呼びます。
\(\displaystyle \rm{Cr(III)}\)はそのまま、再び\(\displaystyle \rm{Cr(V)}\)が酸化剤としてはたらくというループを経て、最終的にすべて\(\displaystyle \rm{Cr(III)}\)がになったときに反応が終了します。
有機金属反応剤による合成
有機金属反応剤とは
有機金属反応剤というのは、下のようの化合物のことです。
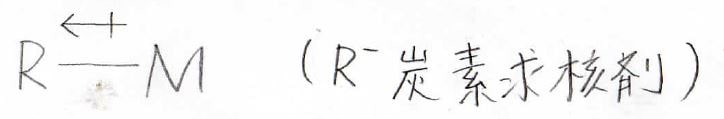
金属の原子にアルキル基が結合しています。
金属原子は電気陰性度がとても小さく、正に帯電しやすいので、そこに隣接している炭素原子は電子richとなります。
これが反応を起こすトリガーとなるわけです。
有機金属反応剤として一般的なのは、アルキル化リチウムです。
ハロアルカンに2等量のリチウムを反応させることで得られます。
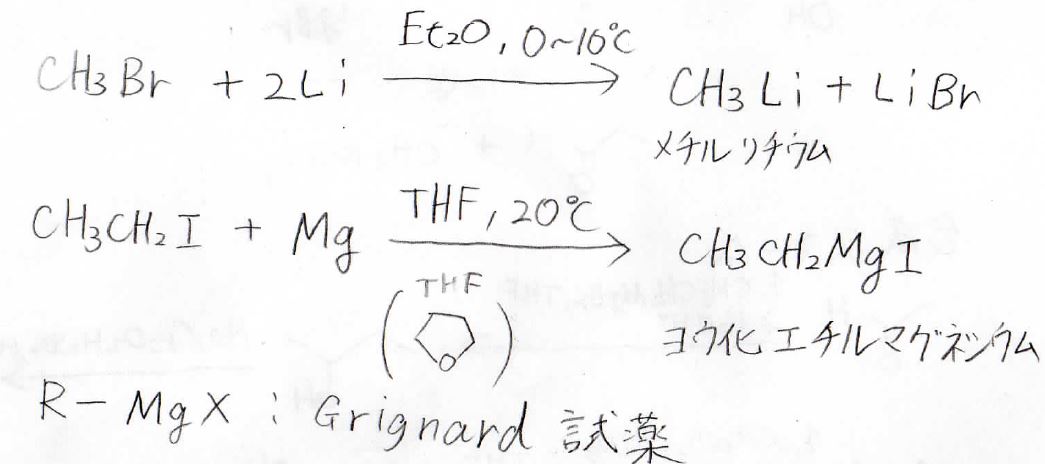
もう1つ有名なのがGrignard(グリニャール)反応剤と呼ばれるものです。
ハロアルカンにマグネシウムを反応させると、このようにアルキル鎖とハロゲンの間にマグネシウムが入ります。
有機金属反応剤の特徴
ここからは、アルキル化リチウムとGrignard試薬の共通する特徴を見ていきます。
逆分極
まず、分極の方向が逆になります。
これらの原料はハロアルカンですが、ハロゲンは炭素より電気陰性度が大きいため、分極して炭素は電子poorとなります。
これが、有機金属になると電子richになるので、反応性に大きな変化が生じることになります。
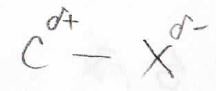
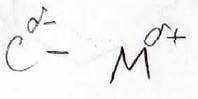
塩基性がとても強い
上の合成で溶媒を見ると、ジエチルエーテルだったり、THF(テトラヒドロフラン)だったりと非プロトン性溶媒を使っているのがわかるかと思います。
これは、生成物が溶媒からプロトンを引き抜かないようにするためです。
例えば、系に水が存在すると、ハロアルカンをアルカンに変えてしまいます。
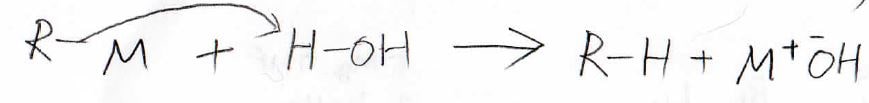
こうなると、金属の水酸化物が生成するだけで、Grignard試薬は作れません。
そのため、有機金属反応剤は必ず禁水条件で作ることになります。
ハロアルカンからアルカンを作る目的ならば、ヒドリド還元剤を使えばいいので、わざわざ有機金属反応剤でやる必要はありません。
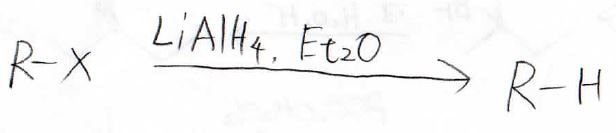
※ただし、重水素置換に使える方法ではあります。
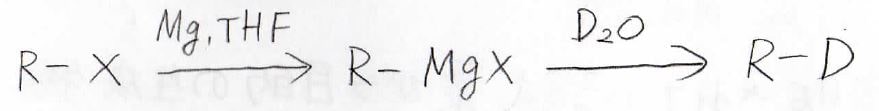
アルコールの合成
そしてここから、有機金属反応剤を使ったアルコールの合成の話に入ります。
この反応剤は求核的なので、カルボニル炭素に求核攻撃します。
1段階目の反応を禁水条件で行い、反応が終わった後に希塩酸などを加えることで、アルコールが得られます。
Grignard反応剤のカルボニルへの求核攻撃は、Grignard反応と呼びます。
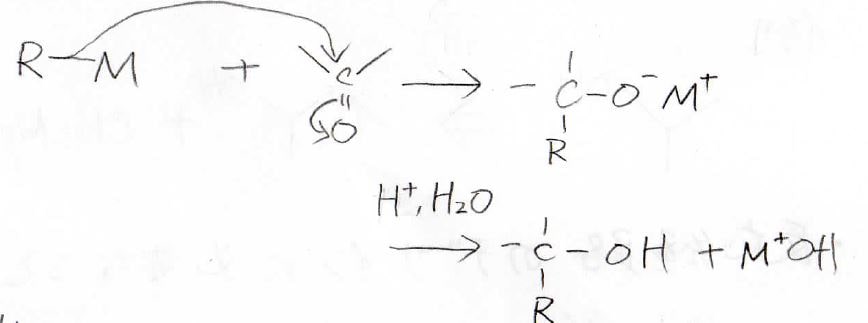
ホルムアルデヒドからは第一級、それ以外のアルデヒドからは第二級、ケトンからは第三級アルコールが生成します。

練習問題
最後に練習問題をやってみましょう。
1. 以下3つの化合物のIUPAC名は?
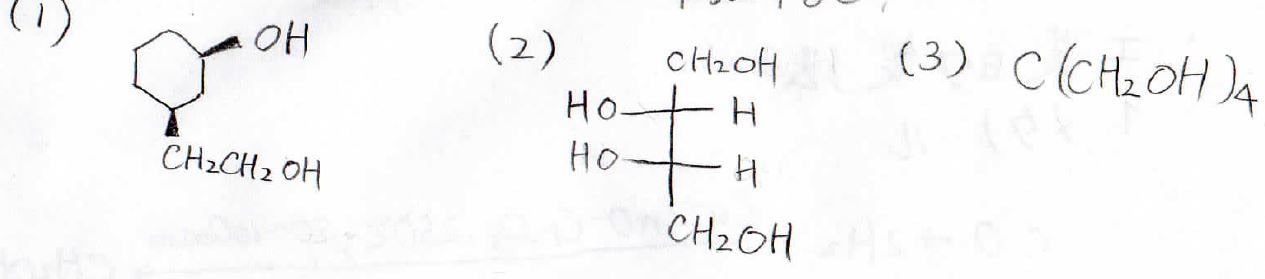
2. これらを酸性度の高い順に並べると、どうなりますか?

3. 以下の反応で得られる生成物の構造は?
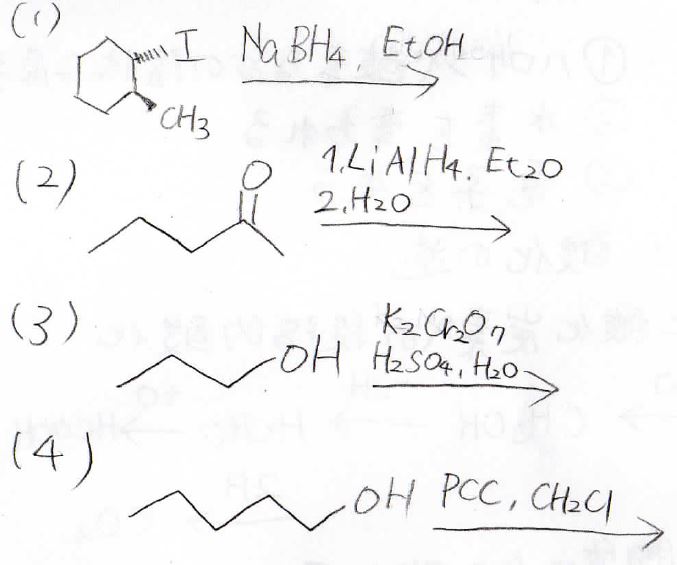
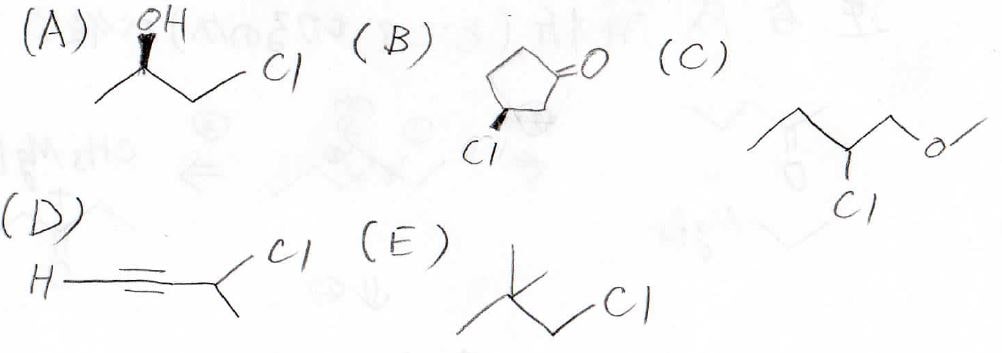
4. 以下のハロアルカンのうち、\(\displaystyle \rm{Mg}\)と反応させてGrignard試薬としてうまく機能するものをすべて選ぶと?
まずシクロヘキサンから直接出ているヒドロキシ基を基準に考えていきます。
2-ヒドロキシエチル基を置換基として考えて、エナンチオマーも考慮すると、(1R,3R)-3-(2-ヒドロキシエチル)シクロヘキサノールとなります。
(2)
炭素鎖にヒドロキシ基が4つ付いているので、これはテトラオールです。
不斉炭素を2つもつ化合物ですが、対称面を置くことができるので、この化合物は光学不活性です。
こういったものはメソ体と呼ばれます。
したがって、このアルコールの名前は、meso-1,2,3,4-ブタンテトラオールとなります。
(3)
基本骨格となる炭素鎖を1つ決めると、そこに結合しているヒドロキシ基は2つとなります。
あとの2つのヒドロキシ基は、炭素も含めてヒドロキシメチル基として扱うので、正解は2,2-ビス(ヒドロキシメチル)-1,3-プロパンジオールとなります。
ヒドロキシメチルのような複数の官能基が組み合わさった複雑な官能基を数えるときは、ジではなくビスを使います。
3つのときは、トリではなくトリスと付けます。
2.
Aは塩素という電子求引基があるので、その誘起効果により酸性度が上がります。
Bではメチル基による立体障害によりイオンの溶媒和が下がります。
これによりイオン解離しにくくなるので、酸性度は下がります。
よって、酸性度が高い順に並べるとA > C > Bとなります。
3.
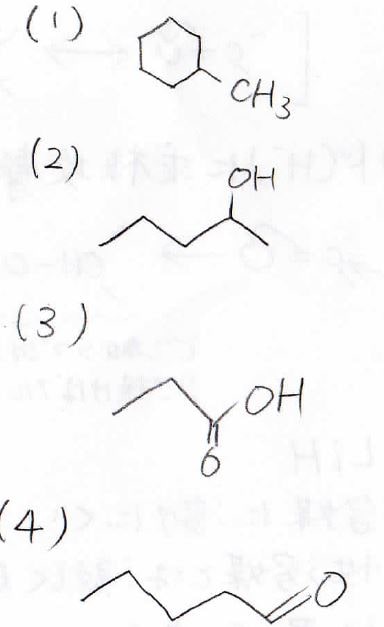
(1)
アルコールに関係ありませんが、ヒドリド還元剤の問題でした。
この系ではヒドリドの求核攻撃が\(\displaystyle \rm{S_N2}\)機構で起こって、メチルシクロヘキサンが生成します。
生成物には不斉炭素がないことに注意しましょう。
(2)
ケトンのヒドリド還元で、第二級アルコールが生成します。
(3)
第一級アルコールの酸化を水を溶媒として行っているので、過剰酸化が起こり、カルボン酸が生成します。
(4)
PCCを使った第一級アルコールの酸化であり、アルデヒドが得られます。
4.
正解はCとEです。
Aでは、ヒドロキシ基の水素がプロトン性なので、強塩基である反応剤がプロトンとして引き抜いてしまいます。
Bでは、カルボニルがあるので、ここと反応が起こってしまいます。
Dは、まだ詳しくやっていませんが、三重結合は\(\displaystyle \rm{sp}\)混成軌道が\(\sigma\)結合を作っています。
\(\displaystyle \rm{sp}\)\(^3\)混成軌道が\(\displaystyle \rm{s}\)軌道1つと\(\displaystyle \rm{p}\)軌道3つからできているのに対し、\(\displaystyle \rm{sp}\)混成軌道は\(\displaystyle \rm{s}\)軌道1つと\(\displaystyle \rm{p}\)軌道1つでできているので、\(\displaystyle \rm{s}\)軌道の寄与(\(\displaystyle \rm{s}\)性)が大きいことになります。
\(\displaystyle \rm{s}\)軌道は\(\displaystyle \rm{p}\)軌道よりも電子の広がりが小さいので、結合中心に電子が集中した構造になり、末端の酸性度が高くなります。
そのため、求核的な炭素との間で反応が起こってしまいます。
CとEでは、これらのような反応が起こらないため、うまくいくと予想されます。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!






