こんにちは!
それでは今日も化学のお話やっていきます。
今回のテーマは、こちら!
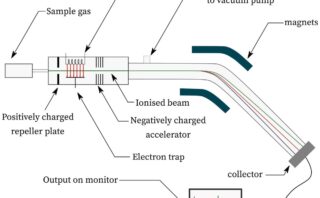
質量分析の原理など基本的なことは、下の記事でお話しているので、そちらを見たあとに、こちらを見るとスムーズだと思います。
動画はこちら↓
動画で使ったシートは、こちら(mass apectrum)
それでは内容に入っていきます!
フラグメント化の原理
まず、フラグメント化について、少しだけ復習します。
質量分析では、分子に電子ビームを当ててできる分子カチオンを検出することで、分子の質量がわかります。
しかしある条件下では、分子イオンが分解して、より小さなカチオンとなって検出されることがあります。

これをイオンのフラグメント化と言います。
分子から電子が1つ外れることで生成するラジカルカチオンのフラグメント化では、一方が1価のカチオン、もう一方がラジカルになります。
電気的に中性なラジカルは磁場中でもLorentz力を受けないため、カチオンだけが検出器まで到達することになります。
そして、その結果このような質量スペクトルが得られます。
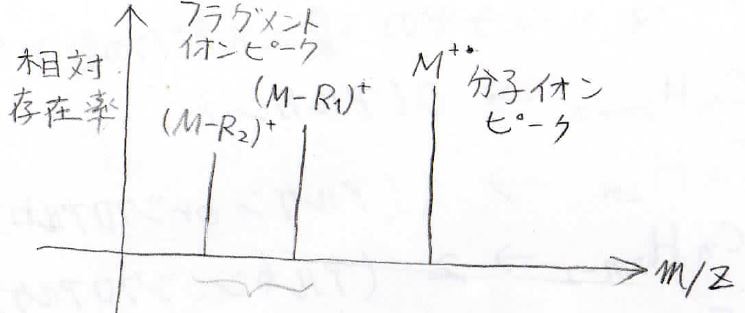
ここでグラフの縦軸はイオンの相対的な存在率、横軸はイオンの質量\(m\)をイオンの価数\(Z\)で除した値です。
\(Z\)がすべて同じ値であるときには、最も右側のピークが分子イオンのピークで、それより左側にあるピークがすべて分子より小さいフラグメントイオンのピークになります。
そのフラグメント化反応が、熱力学的に有利なほど、大きなフラグメントイオンピークが得られることになります。
アルカンのパターン
では始めに、アルカンはどこで切れやすいのか考えていきます。
ここで思い出してもらいたいのが、カルボカチオンの安定性です。

カチオン中心の炭素は\(\displaystyle \rm{sp}\)\(^2\)混成による平面構造をとり、その平面と垂直な方向へ空軌道をもちます。

そこに隣接している\(\displaystyle \rm{sp}\)\(^3\)炭素があると、空軌道へ少し非局在化が起こり、安定になります。
これが超共役で、第三級カルボカチオンが最も安定となり、第一級カルボカチオンやメチルカチオンが不安定になります。
したがって、アルカンのフラグメント化は多置換中心で起こりやすいということになります。
例えば、こちらの2-メチルブタンだと、2番目の炭素の周りで解離が起こりやすいと推測されます(実際は解離しにくい。理由は後述)。
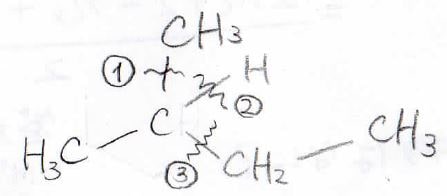
①から③の部分で切れると、それぞれ下のようなカルボカチオンができます。
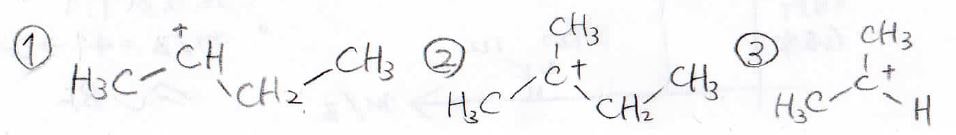
①と③は第二級、②が第三級のカルボカチオンです。
そして、2-メチルブタンのMSはこのようになります。
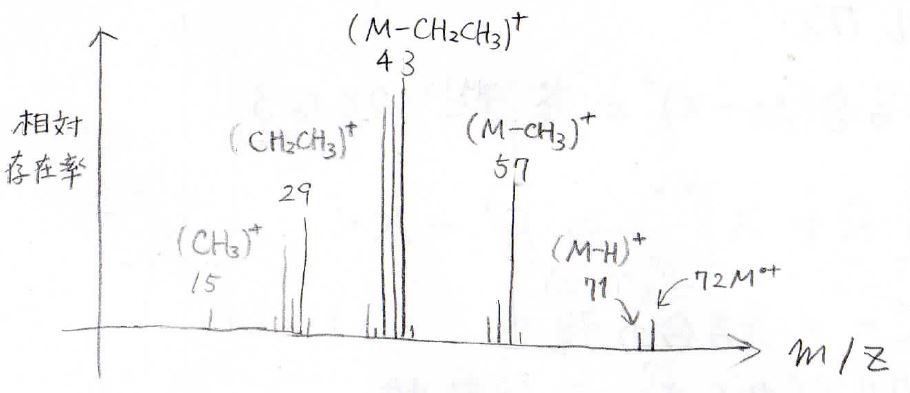
最も右側の\(m/Z=72\)というのが分子イオンで、\(m/Z=71\)のピークはそこから水素原子が外れたイオンに対応します。
水素がなくなったのは、\(\displaystyle \rm{M-H}\)と表記します。
そして、\(m/Z=57\)はメチル基、\(m/Z=43\)はエチル基がなくなったものです。
このスペクトルからわかることとしては、まず第三級カルボカチオンであるはずの\(m/Z=71\)のピークですが、その強度はとても小さくなります。
これは、水素原子が不安定なためです。
同様にメチルラジカルも不安定なので、\(m/Z=57\)のピークも少し小さくなります。
また、アルカンが分枝を持つほどフラグメント化が起こりやすくなるため、最も右側の分子イオンピークの強度は小さくなっていきます。
アルコールのパターン
それでは続いて、アルコールを考えていきましょう。
主要なフラグメント化の機構は2つあり、1つ目は水の脱離です。
水分子はとても安定な化学種であるため、簡単に外れることができます。
したがってアルコールでは、分子イオンよりも\(18\)質量小さいところに大きなピークが現れることになります。

そして、フラグメント化の機構2つ目は\(\displaystyle \alpha\)開裂です。
ヒドロキシ基がついた炭素の位置を\(\displaystyle \alpha\)位と言いますが、ここの炭素と隣の炭素の間の結合が切れると、このようなヒドロキシカルボカチオンができます。
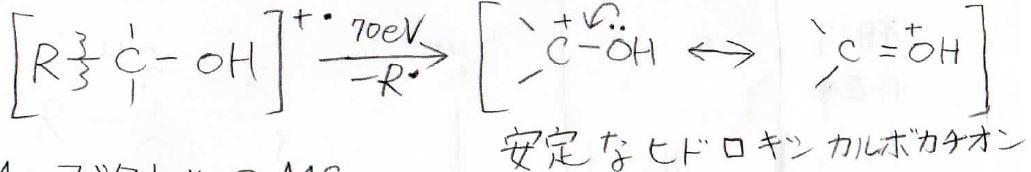
このような共鳴が起こるため、このカチオンは安定であり、ここでフラグメント化が起こりやすいことになります。
実際に1-ブタノールのMSは下図のとおりで、\(m/Z=74\)の小さな分子イオンピークに対して、そこから\(18\)質量小さい\(m/Z=56\)はとても大きくなります。
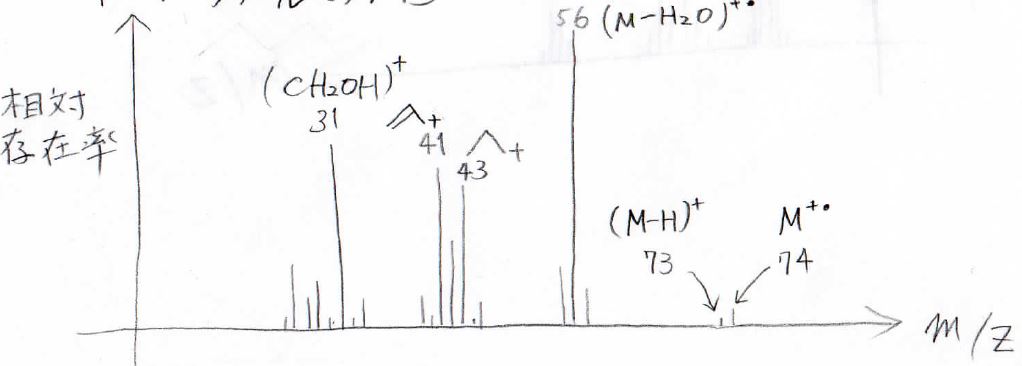
また、\(\displaystyle \alpha\)開裂が起こってできた\(m/Z=31\)のヒドロキシメチルカチオンのピークも大きく出ています。
そして、ヒドロキシラジカルが抜けたときにできる1-プロピルカチオンと、さらにそこから水素分子が抜けた2-プロペニルカチオンのピークがそれぞれ\(m/Z=43\)と\(m/Z=41\)に出てきます。
やはりアルコールでも、水素原子が外れる\(m/Z=73\)のピークは小さくなっています。
ハロアルカンのパターン
続いてお話するのは、ハロアルカンです。
フッ素を除くハロゲンでは、炭素原子との結合がそこまで強くないので、簡単に解離が起こります。

そのため、ハロゲン原子が脱離したカチオンのピークが基準ピーク、すなわち最も強度の高いピークになることが多いです。
また当然ですが、生成するカルボカチオンの安定性によってもピーク強度は上下します。
アルケンのパターン
最後は、アルケンです。
結論を先にいうと、アルケンのフラグメント化は、アリル位の結合で起こりやすいです。

これはアルコールの\(\displaystyle \alpha\)開裂と同様、生成するアリルカチオンが、このような共鳴構造をとり、安定化が起こるためです。
上と同じ1-ブテンのMSはこのようになり、\(m/Z=56\)の分子イオンピークのほか、\(m/Z=41\)に2-プロペニルカチオンのピークが出てきます。
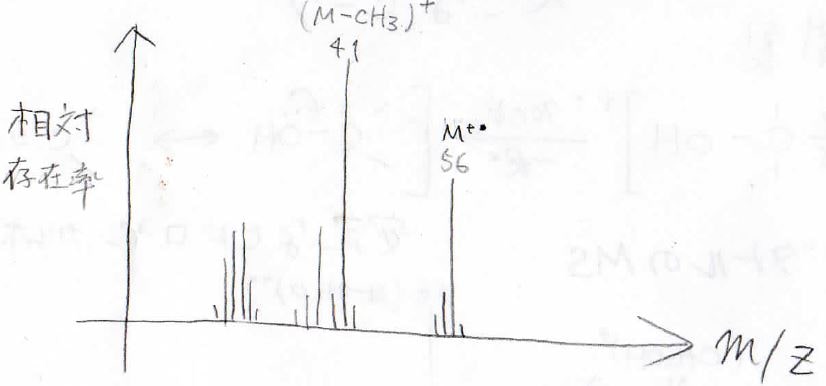
\(m/Z\)の値には便利なものがいくつかあって、例えばこの\(41\)という数字を覚えていれば、スペクトルを見ただけで、末端アルケンかなと推測することもできます。
不飽和度
それで、ここからは質量分析に限らず、化合物を同定したいときの補助的な手段を、おまけとして紹介しておきます。
例えば、高分解能の質量分析により分子式が\(\displaystyle \rm{C_6H_{12}}\)だとわかったことにしましょう。
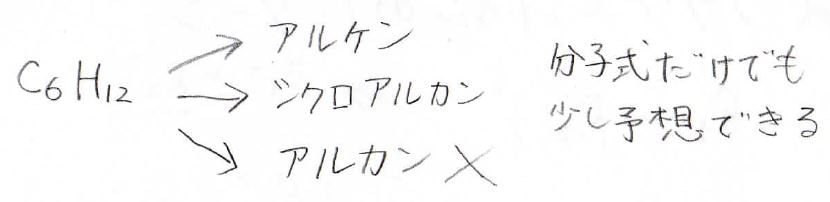
このとき考えられる構造は、アルケンやシクロアルカンがありますが、確実に言えるのは、少なくともアルカンではないということです。
それは、次のような理屈からわかります。
まず、分子内の環と\(\displaystyle \pi\)結合の個数を足した値は、不飽和度と呼ばれます。

不飽和度\(0\)のアルカンでは、水素原子の個数は(炭素原子の個数)\(\times 2+2\)個になります。
不飽和度が\(1\)のアルケンやシクロアルカンでは、アルカンから水素原子が\(2\)個減ります。
そして、アルキンやシクロアルケンなど不飽和度が\(2\)になると、さらに水素原子は\(2\)個減ります。
より一般的に、窒素やハロゲンなどヘテロ原子を含む場合は、まず炭素原子の個数\(n_\rm{C}\)に\(2\)をかけてそこに\(2\)を足します。
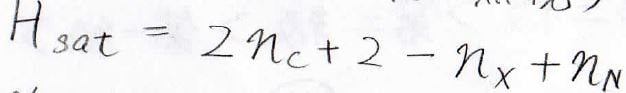
そこからハロゲン原子の個数\(n_\rm{X}\)を引いて、窒素原子の個数\(n_\rm{N}\)を足した値が、不飽和度\(0\)のときの水素原子の個数\(H_\rm{sat}\)になります。
酸素原子や硫黄原子は無視してください。
不飽和度が\(1\)大きくなると、水素原子は\(2\)個減るという法則より、この\(H_\rm{sat}\)から実際の水素原子の個数\(H_\rm{actual}\)を引き、\(2\)で割った値が不飽和度になります。
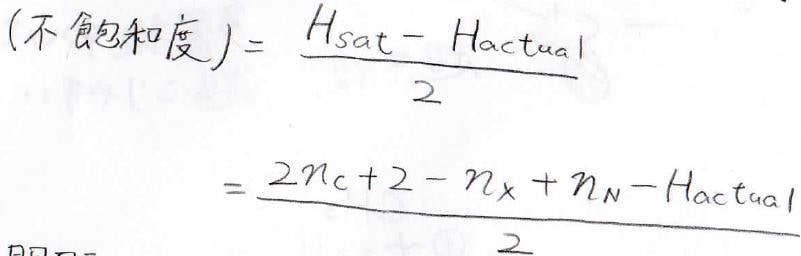
\(\displaystyle \rm{C_6H_{12}}\)の不飽和度は\(\displaystyle 1\)なので、アルカンではないと言えます。
練習問題
そここで、1つ質量分析の練習問題をやってみましょう。
下のようなMSが得られたとき、どんな化合物が考えられるでしょうか?
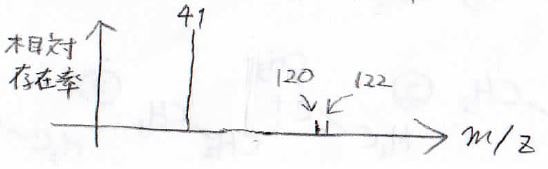

まず、\(m/Z=41\)のピークがあって、さらに分子イオンピークが小さいことから末端アルケンであると推測できます。
そして、分子イオンピークはほとんど同じ強度で\(2\)本見られることから、これは質量数\(79\)と\(81\)が約\(1:1\)で存在している臭素原子の存在を示唆します。
したがって、考えられる化合物は3-ブロモプロペンになります。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!




