こんにちは!
それでは今回も化学のお話ししていきます。
今回のテーマは、こちら!
動画はこちら↓
動画で使ったシートはこちら(mass analysis1)
それでは内容に入っていきます!
他の化合物同定法との違い
まず、これまでやってきた化合物同定法について、具体的にどんな情報が得られることで同定につながるかを思い出してみましょう。
NMR

例えば、核磁気共鳴法(NMR)であれば、化学シフトから官能基の存在がわかり、スピン-スピン分裂により主には隣接する原子核との位置関係を調べることができました。
そして、¹H-NMRでは、得られたピークの積分比から、等価な原子核の個数比を知ることができました。
詳しくは、これらの記事で解説しています。






IR

続いて、赤外分光法(IR)ではどうかというと、波数で\(1500 \rm{cm}^{-1}\)より大きい領域で官能基の存在、\(1500 \rm{cm}^{-1}\)より小さい領域で分子全体の構造が見えます。
これらの領域は、それぞれ診断領域、指紋領域と呼ばれます。
ただし、指紋領域のスペクトルは非常に複雑となることが多いので、分子構造の特定には、コンピュータによる計算が必要となります。
詳しくは、こちらを参照してください。
元素分析
では、最後に高校でも習った元素分析では、どうでしょうか?

元素分析とは、燃焼法を例にお話ししますと、こんな風に有機化合物を酸素共存下で燃焼させ、得られた水と二酸化炭素の生成比、そして、反応によって消費された酸素の量から、元素がどういう割合で含まれているのか、すなわち組成式がわかります。
注意したいのは、決して分子式がわかるわけではないということです。
例えば、1-オクテンの元素分析をしたところで、それが1-ブテンなのか、シクロヘキサンなのかを判別することはできません。
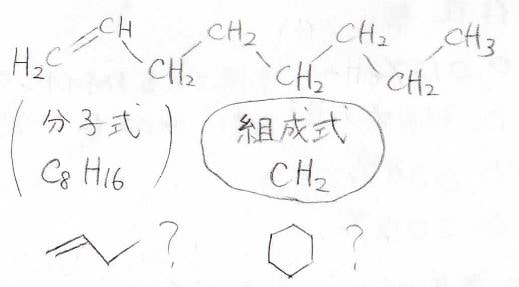
判別できるとしたら、1-ブテンは気体で、1-オクテンは液体なので、1-ブテンはないだろうということくらいです。
つまり、ここまで見てきた化合物同定法は、いずれも元素の個数がわかったとしても、個数比としてしか出ないというのもあり、分子式を決めるには、不十分であったり、複雑すぎたりするという欠点がありました。
今回紹介する質量分析は、分子1個の質量を知ることができるため、分子式を容易に求めることができるというのが、大きな特徴の1つになります。
質量分析法の原理
それでは、もっと具体的に、質量分析についてお話ししていきます。
磁場中における荷電粒子の運動
装置図をお見せする前に、まず高校物理をやります。
考えるのは、磁場中で運動する荷電粒子で、Lorentz力を向心力とした等速円運動をしていることとします。

回転する方向は、フレミングの左手の法則からわかり、向心力の式より、磁束密度\(B\)はこのように導かれます。

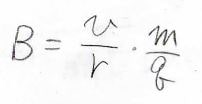

ここで、\(v\)は粒子の速度、\(r\)は円運動の半径、\(m\)は質量、\(q\)は粒子の電荷を表します。
また、この荷電粒子がイオンである場合には、その電荷が電気素量\(e\)に価数\(Z\)をかけた値になります。
生物選択だった方には、難しいかもしれませんが、これが質量分析の原理になります。
質量分析法の測定装置
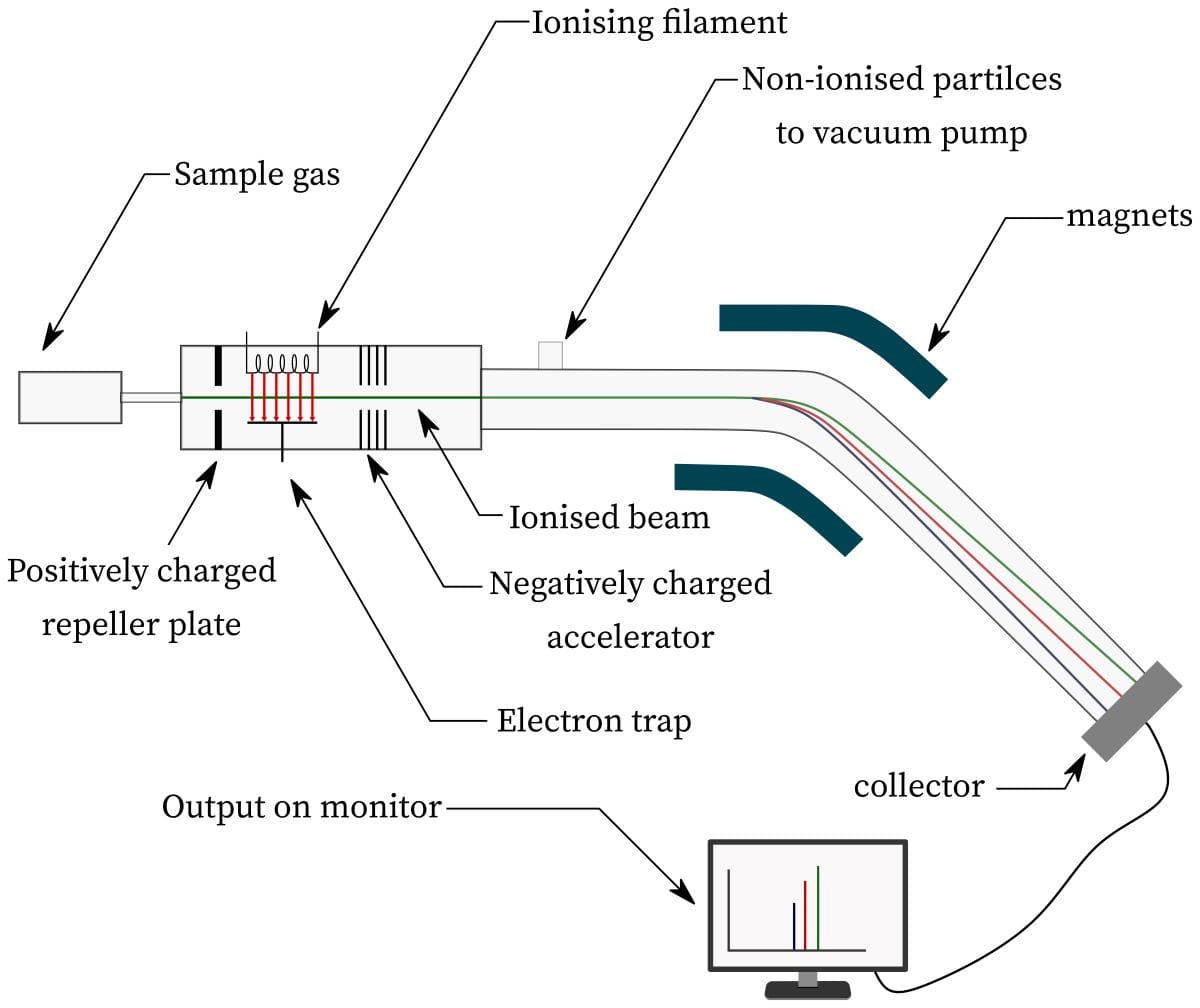
そして、測定装置の模式図がこんな感じです。
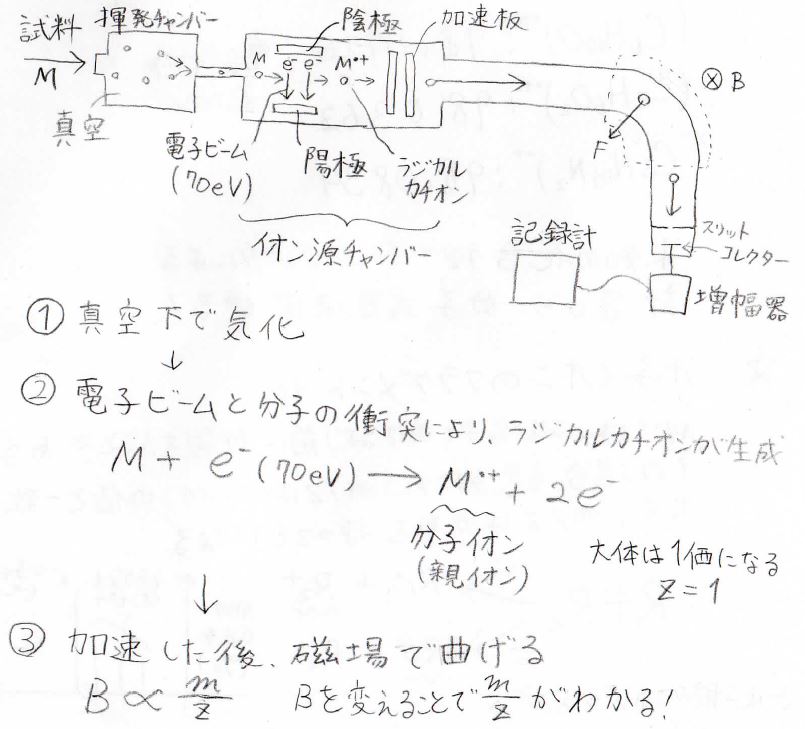
まず左上の部分から、試料を注入し、真空とすることで、気体にします。
気体となった分子は、その圧力で押し出され、右の空間に移り、そこでは電子ビームを当てられます。
すると、一部の分子が電子と衝突し、電子がはじき出されることで、カチオンが生成します。
このとき、1個の電子がはじき出された場合には、ラジカルカチオンができます。
できたカチオンは、加速させたのち磁場により回転させられ、最後検出器まで到達するというのが概要です。
電子ビームのエネルギーは、通常\(70 \rm{eV}\)程度で、生成するカチオンの多くは1価になります。
このようにして生成したカチオンは、元の分子とほとんど同じ質量を持っているため、分子イオンもしくは親イオンと呼ばれます。
そして、磁束密度がイオンの質量に比例し、価数に反比例するということを利用すると、磁束密度を変化させることで、検出器まで到達するイオンの\(m/Z\)も変えられるため、そこから質量の判別が可能になります。
\(Z=1\)とならない場合を除き、最も大きい\(m/Z\)の値がその分子1個の質量です。
質量分析の分解能
それでは、ここからは質量分析の細かな注意点を確認していきましょう。
先ほどの原理の話で、質量がわかるということは、なんとなく納得してもらえたかなと思いますが、こう考える方がいるかもしれません。
分子の質量がわかったところで、こんな風に同じ整数質量を持つ化合物を判別することができなければ、化合物同定に使えないということです。
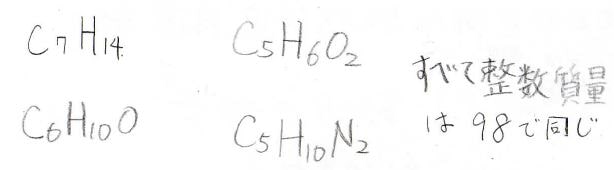
確かにそうですが、実は現在発明されている高分解能質量分析を使えば、これらの判別も可能となっています。
なぜなら、¹²C以外の原子の原子量は、厳密な整数という訳ではなく、微妙なずれがあるからです。
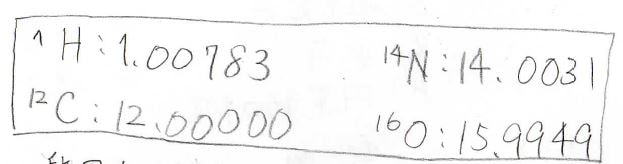
実際に、それぞれの\(m/Z\)の値はこのように測定することができまして、十分これらを区別することができています。
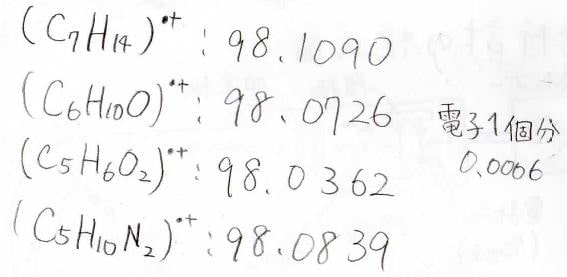
これにより、もっと複雑な未知の化合物であっても、\(m/Z\)の値からコンピュータの計算により分子式を推測することも可能になりました。
イオンのフラグメント化
そして、続いての話題ですが、実は、得られるピークが1つだけとは限りません。
と言うのも、生成したラジカルカチオンが、磁場中で曲げるよりも前に分裂する現象が起こるからです。
この現象は、フラグメント化と呼ばれ、\(m/Z\)は分布を持つようになります。
例えばこんな化合物のラジカルカチオンがあったとして、その真ん中でフラグメント化が起こった場合には、一方がカチオンで、もう一方がラジカルになります。
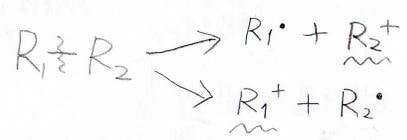
そしてラジカルは電気的に中性なため、カチオンだけが磁場で曲げられることになります。
とは言っても、すべての分子イオンがフラグメント化するわけではなく、ランダムなので、このような\(m/Z\)の分布が得られます。
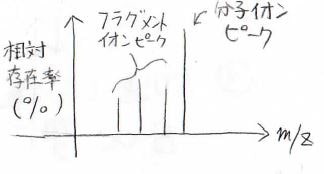
横軸が\(m/Z\)、縦軸がピーク強度であり、これはイオンの相対的な存在率に対応します。
最も大きい\(m/Z\)の値を示すピークは、分子イオンに対応しており、分子イオンピークと呼ばれます。
それよりも左側に出てくるピークは、フラグメントイオンに対応しており、フラグメントイオンピークと呼びます。
そして、このような分布を示したものを質量スペクトルと言います。
また、MSと書いて、マススペクトルあるいは、マスとだけ言うことも多いです。
また、先ほどグラフの縦軸を相対的なイオンの存在率だということを言いましたが、それは最も強度の大きいピークを基準、すなわち\(100\%\)にした値として決められます。
そのため、最も強度が大きいピークは、基準ピークと呼ばれます。
そして、イオンのフラグメント化は、完全にランダムという訳ではなく、どこで起こりやすいといったルールがありますが、それをここで話すと長くなってしまうので、続編の記事でゆっくりお話ししていこうと思います。
同位体の影響
そして最後の話題ですが、実はフラグメント化以外にも\(m/Z\)が分布を持つ原因があります。
それは、同位体の存在です。
例えば、1-ブロモベンゼンのMSはこのようになっていまして、最も右側に強度がほとんど同じピークが2本現れます。
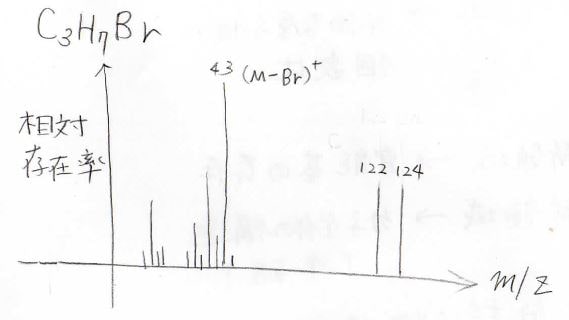
その理由が同位体であり、\(Z=1\)として、\(m=122\)のピークは⁷⁹Br、\(m=124\)のピークは⁸¹Brを含む分子イオンに対応します。
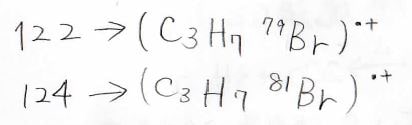
こんな風に質量分析では、個々のイオンを見ているため、同位体があると、それを別のものとして検出してしまいます。

そのため、予想される分子イオンピークよりも大きい質量側に小さなピークが得られることがあります。
特に塩素の場合は、³⁵Clと³⁷Clがほぼ\(3:1\)、臭素は⁷⁹Brと⁸¹Brがほぼ\(1:1\)となるため、ピーク強度の比から塩素や臭素が含まれているということを判別することもできます。
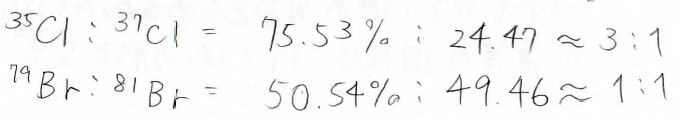
まとめ
はい、それでは今回の内容は以上なので、最後おさらいをやって終わります。
今回は質量分析法の原理についてお話ししました。
質量分析が他の化合物同定法と比べて優れていることは、組成式ではなく分子式を比較的簡単に特定することができるということでした。
質量を判別するためには、Lorentz力を利用しているため、分子を気化させて、電子ビームによりカチオンを生成させる必要があります。
そのイオンを電場により回転させ、目的の質量を持つイオンだけを検出器に到達させます。
実験中に変化させるのは磁束密度であり、実際には、分子の質量そのものではなく、質量をイオンの価数で割った値が求められます。
ただし、その価数は多くの場合、\(1\)になります。
そして、原子量には微妙な整数とのずれが存在しているため、高分解能で質量を調べることで、同じ整数質量を持つ化合物でも判別することが可能となります。
そして、質量分析で得られるピークは、必ずしも1つにはならず、分布を持つことがあります。
この分布は、マススペクトルとか、マスとか呼ばれ、MSで表されます。
分布が現れる要因は、イオンのフラグメント化と同位体の影響であり、フラグメント化のルールについては、続編の動画でまたやっていきたいと思います。
お話はこれで以上です。
それではどうもありがとうございました!