こんにちは!
それでは今日も化学のお話をしていきます!
今回のテーマはこちらです!
動画はこちら↓
動画で使用したシートはこちらから↓
シグナル伝達の種類
まずは、シグナル伝達の種類について説明していきます。
ヒトの体では、シグナル伝達では電気的な信号、もしくはシグナル伝達物質を放出したり活性化したりすることによって行われます。
さらに、電気的な信号も陽イオンまたは陰イオンが流入することによって行われることを考えると、体内でのシグナル伝達はすべて何らかの物質によって行われていると言えます。
GPCR
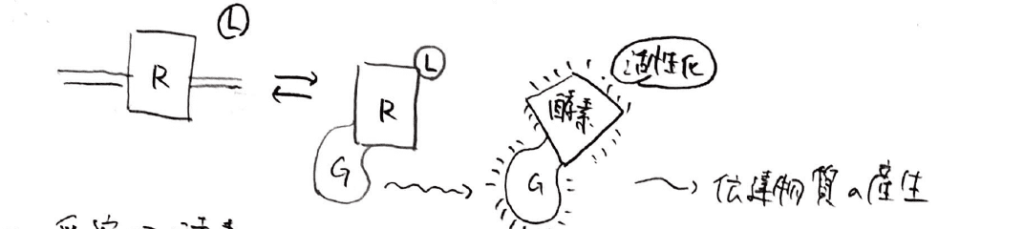
シグナルを伝達する機構は大きく分けて4つあり、1つ目が今回詳しく解説するGPCRです。
細胞の外からGPCRなどの受容体に特異的に結合する物質をリガンドと呼び、その中でも、シグナルを活性化するものをアゴニストと呼びます。
GPCRにアゴニストが結合すると、細胞内で情報伝達を担う物質を合成する酵素が活性化されます。
その物質によってさらに次の物質が変換されたり機能が調節されたりすることで、シグナルが伝達されていきます。
詳しくは、次の章で解説していきます。
受容体酵素
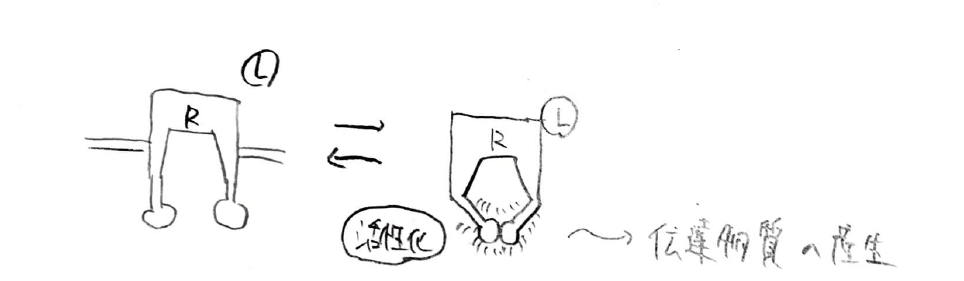
2つ目は、受容体酵素と呼ばれるものです。
細胞外からリガンドが結合すると、この物質も細胞内でシグナルを伝達しますが、GPCRと異なるのは、この受容体自身が酵素となっており、直接伝達物質を生成する点です。
イオンチャネル
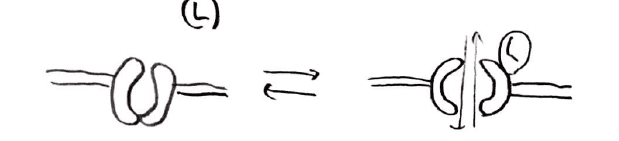
3つ目は、イオンチャネルです。
このタイプの受容体は、単純に電位差などに応じてイオンを細胞内外に通す役割をもっています。
神経の伝達は、ナトリウムイオンチャネルの連続で構成されていることからも、イオンチャネルは非常に重要な役割をもっていることがわかります。
核内受容体
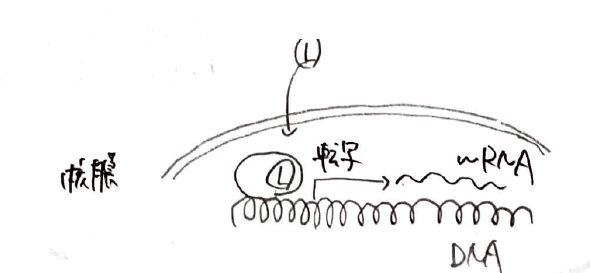
4つ目は、核内受容体と呼ばれるものです。
今までに紹介した3つのものが細胞膜上に存在しているのに対し、このタイプの受容体は核内に存在し、リガンドが結合すると遺伝子の転写および翻訳を行い、タンパク質を合成することでシグナルを伝達します。
伝達物質を介したシグナル伝達には、4つの手段がありますが、今回はGPCRについて詳しくみていきます。
GPCRの構造
GPCRは主に3つの部分から構成されており、その3つとは細胞膜貫通領域、Gタンパク質、およびエフェクター酵素です。

細胞膜貫通領域は、その名前のとおり、細胞膜を貫通している部分(多くは7回貫通)です。
細胞外にはリガンドが結合できる部位があり、細胞内にはGタンパク質と結合する部位をもっています。
Gタンパク質は、不活性時はGDPと結合していますが、GTPと結合すると活性化されて細胞膜貫通領域から解離します。
エフェクター酵素は、活性化したGタンパク質が結合すると活性を発揮する酵素で、さまざまな伝達物質を生成します。
Gタンパク質の性質
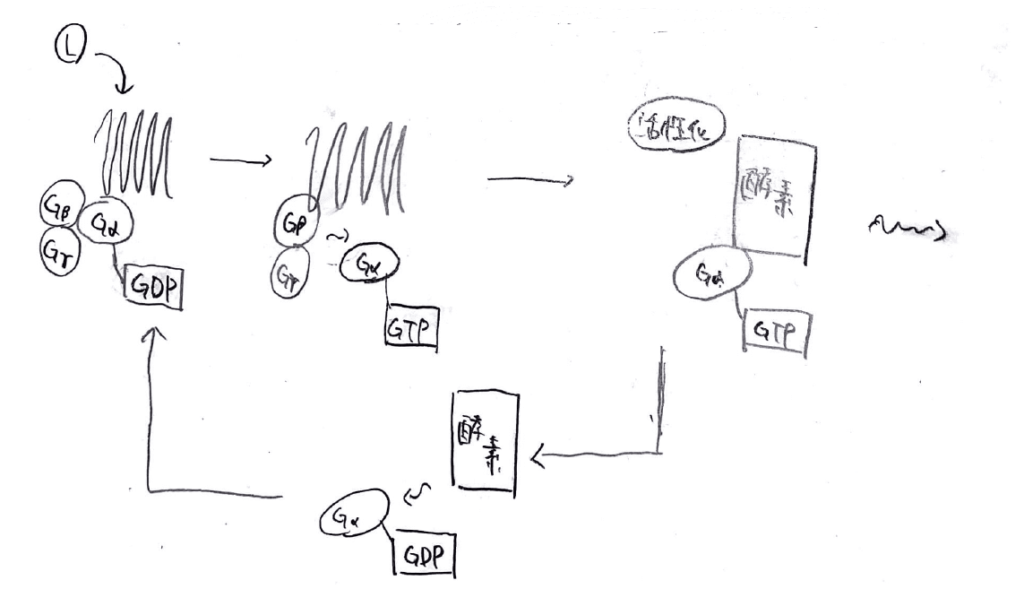
Gタンパク質はGα、Gβ、Gγの三種類のサブユニットから構成されています。
リガンドがGPCRに結合すると、Gαに結合していたGDPがGTPに交換される反応が起きます。
そうすると、Gαサブユニットは他の二つのサブユニットから解離して、エフェクター酵素に結合し、酵素は活性化されます。
酵素が化合物を変換する反応が終わると、エフェクター酵素がもつGTPアーゼ活性(GTPを加水分解してGDPに変換する能力)によって、Gαに結合していたGTPはGDPに戻り、エフェクター酵素から解離して元の位置に戻ります。
GPCRの種類
GPCRには主に3種類のタイプがあり、それぞれGs、Gi(もしくはGi/o)、Gqと呼ばれています。
まずは、3つの役割を簡単に説明していきます。
GsはサイクリックAMP、通称cAMPの濃度を上昇させ、逆にGiはcAMPの濃度を下げます。
このcAMPはアデニル酸シクラーゼによってATPから合成される物質で、体内でメッセンジャーとして、さまざまな役割を果たしています。
一方で、Gqは細胞内のカルシウムイオンの濃度を上昇させる役割をもちます。
それぞれのタイプは異なる部位に分布し、体内で適切な役割を果たしています。
Gs型の作用

Gs型の作用について見ていきます。
1.まずリガンドが受容体に結合すると、Gαサブユニットに結合しているGDPがGTPに交換され、遊離してエフェクター酵素であるアデニル酸シクラーゼに結合します。
2.そうすると、アデニル酸シクラーゼは活性化します。
3.アデニル酸シクラーゼはATPをcAMPに変換し、cAMPは様々なタンパク質をリン酸化するプロテインキナーゼA、通称PKAを活性化させます。
4.その後、PKAによってさまざまなタンパク質がリン酸化され、機能が調節されます。
5.刺激が終了すると、cAMPはサイクリックヌクレオチドホスホジエステラーゼという酵素によって加水分解されてAMPに戻り、元の状態に戻ります。
PKAの活性化
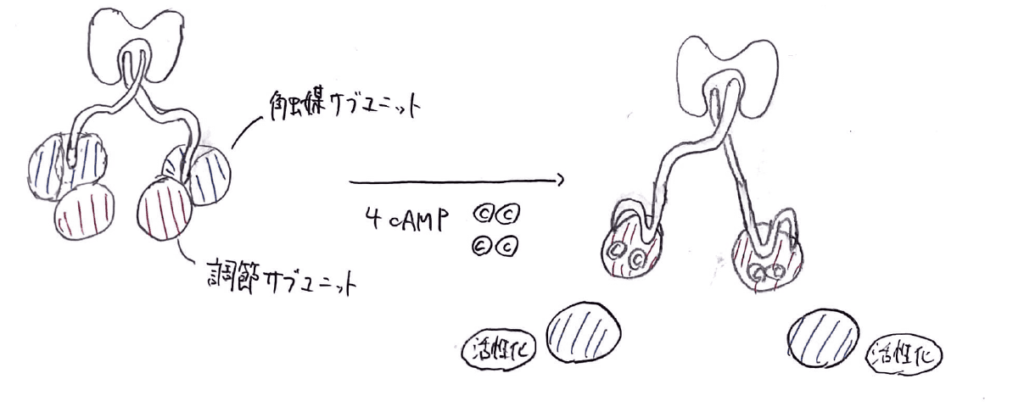
ここで、PKAの活性化のしくみについて少し補足します。
PKAは2本の手からなる構造をしており、それぞれに調節サブユニットと触媒サブユニットが1つずつ結合しています。
通常状態では、調節サブユニットが触媒サブユニットと結合しており、触媒作用はありません。
しかし、cAMPが4分子結合すると、触媒サブユニットは解離することができ、触媒作用を発揮することができるようになります。
応答を終了させる機構(脱感作)
では、リガンドの刺激による応答を終了させる機構について解説していきます。
刺激が完了したときにはたらく機構については、主に3点あります。
1.アゴニスト濃度の低下
2.Gαに結合するGTPがGDPに加水分解される
3.cAMPが加水分解されてAMPに戻る
などといったものが考えられます。
しかし、シグナルが続いている間にも応答を終了させる機構をもち、それが脱感作と呼ばれるものです。
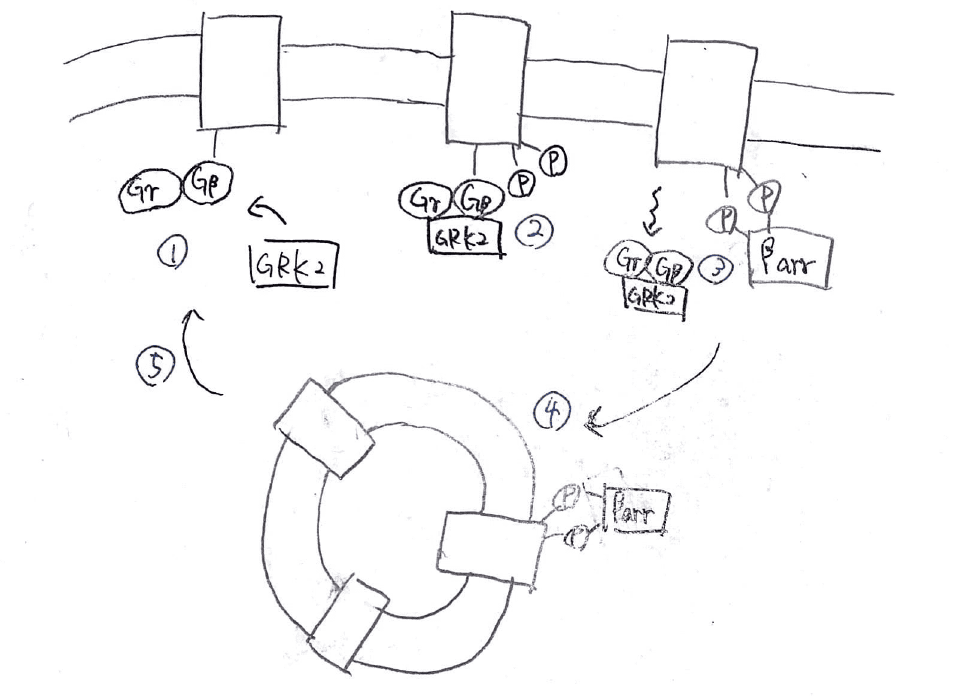
1.Gαサブユニットが解離している状態のGPCRのGβ、Gγサブユニットに、GRK2と呼ばれるタンパク質が結合します。
2.GRK2によって、GPCRがリン酸化されます。
3.リン酸化された部分にβアレスチンというタンパク質が結合します。
4.βアレスチンがGPCRに結合すると、GPCRはエンドサイトーシスによって細胞内に取り込まれ、作用することができなくなります。
これが脱感作のしくみです。
その後、βアレスチンがGPCRから解離すると、GPCRは再び細胞膜上に移動し、元の状態にもどります。
Gi型の作用
話を戻して、GPCRの種類について見ていきます。
Gi型はGs型と真逆のはたらきをします。
GiのGαサブユニットはアデニル酸シクラーゼを不活性化するため、cAMPの濃度は低下します。
そのため、その後のシグナル伝達も、Gsとは真逆のものとなっていきます。
Gq型の作用
Gq型のGPCRは、細胞小胞体の中にあるカルシウムイオンを細胞質中に流入させることが主な役割です。
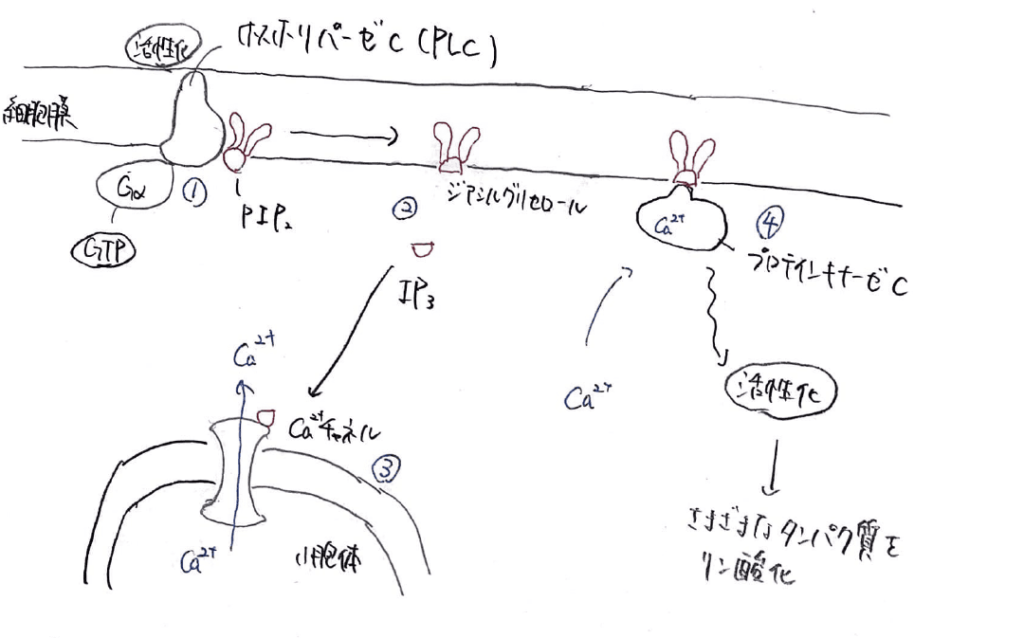
1.GTPと結合したGαタンパク質は、エフェクター酵素であるホスホリパーゼC、通称PLCに結合し、活性化させます。
2.PLCは細胞膜上にあるPIP2という脂質を加水分解し、細胞膜上にはジアシルグリセロールが残り、細胞質中にはIP3と呼ばれる物質が流入します。
3.このIP3が小胞体の膜上にあるカルシウムイオンチャネルに結合すると、チャネルが開いて、カルシウムイオンは濃度がより低い細胞質中へと受動的に流れ込みます。
4.細胞質中のカルシウムイオン濃度が上昇すると、プロテインキナーゼC、通称PKCという酵素にカルシウムイオンが結合し、活性化させます。
この機構で、様々なタンパク質がリン酸化され、シグナルが伝達されていきます。
カルシウムイオン結合タンパク質
また、細胞内には、PKC以外にもさまざまなカルシウムイオン結合タンパク質が存在します。
トロポニンは、カルシウムイオンが結合すると構造が変化し、骨格筋を収縮させます。
カルモジュリンはイオン濃度が上昇するとCaMキナーゼと呼ばれる酵素を活性化させ、この酵素がさまざまなタンパク質をリン酸化して、機能を調節します。
このように、Gq型のGPCRはさまざまな作用を起こす能力をもち、体内で非常に重要な役割を果たしています。
GPCRのシグナル増幅力
GPCRは、非常にシグナルを増幅させる能力が高い受容体です。
GPCRがどれだけシグナルを増幅させる力をもっているか、アドレナリン受容体を例に紹介していきます。
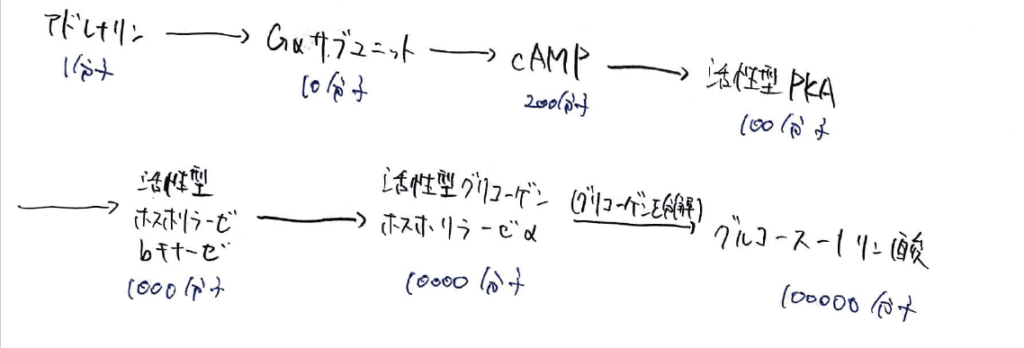
アドレナリン受容体にアドレナリンが1分子結合すると、10分子のGαサブユニットが活性化され、200分子のcAMPが生成されます。
そこから100分子のPKAが活性化し、活性化ホスホリラーゼbキナーゼが1000分子活性化されます。
さらにそこから、活性型グリコーゲンホスホリラーゼαが10000分子活性化され、グリコーゲンを分解することで、グルコース1-リン酸が100000分子生じます。
このように、たった1分子のアドレナリン分子から次々とシグナルが増幅されていき、最終的には非常に大きな数の分子が生成されたり、調節を受けたりするという「シグナルの増幅力」がGPCRのメリットです。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!