こんにちは!
それでは今日も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(conjugated diene)
シートの後半部分は、次回の内容です。

共役ジエンの命名法
まず、ジエンとは、アルケンの中で特に二重結合を2つもつ化合物のことです。
ここに示したのは、ジエンの中でも共役ジエンと呼ばれるものです。
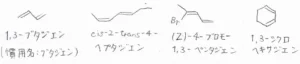
IUPAC名をつけるときは、2つの二重結合を含む最も長い炭素鎖を見つけて、対応するアルカンのaneをadieneに変えます。
いちばん左の1,3-ブタジエンは、最も単純な共役ジエンで、一般的にブタジエンと言えば、1,3-ブタジエンのことを指します。
ちなみに、「butadiene」の日本語読みはドイツ語に準拠していて、英語の発音は「bjùːtədáiiːn(ビュータダイイーン)」と全然違うので、ぜひ知っておいてください。
分子軌道図
上記の化合物では、4つの炭素原子が同一平面上に位置しており、それぞれの\(\displaystyle \rm{p}\)\(\)軌道は平行な関係にあるので、相互作用することができます。
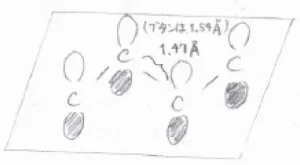
2番目と3番目の炭素原子を結ぶ単結合は、一般的な単結合に比べて強く、回転するには\(\displaystyle 7\ \rm{kJ\ mol}\)\(^{-1}\)ほどの活性化障壁を超える必要があります。
水素化熱
共役ジエンが\(\displaystyle \rm{p}\)\(\)軌道どうしの相互作用によって安定となっていることは、水素化熱を比較することで確かめられます。
白金触媒で水素分子と反応させたときのエンタルピー変化は、こちらのとおりです。
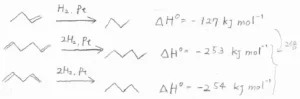
アルケンの1つの二重結合を水素化させたときのエンタルピー変化が\(\displaystyle -127\ \rm{kJ\ mol}\)\(^{-1}\)であるのに対して、その下2つのジエンのエンタルピー変化はおよそ\(\displaystyle -254\ \rm{kJ\ mol}\)\(^{-1}\)となっています。
アルケンの値とは2倍の関係となっており、これは単純に二重結合の数に比例して水素化熱が増加したと考えられます。
しかし、共役ジエンであるブタジエンのエンタルピー変化は\(\displaystyle -239\ \rm{kJ\ mol}\)\(^{-1}\)であり、およそ\(\displaystyle 15\ \rm{kJ\ mol}\)\(^{-1}\)の差が生じます。
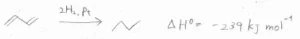
これが、4つの\(\displaystyle \rm{p}\)\(\)軌道間で起こる相互作用による安定化を表しています。
ヒュッケル法
ここで、前回お話ししたアリル型中間体と同様に、ヒュッケル法から導かれる分子軌道を思い出してみましょう。
計算過程は、こちらの記事を参照してください。
4つの\(\displaystyle \rm{p}\)\(\)軌道から、4つの\(\displaystyle \pi\)軌道が作られます。

そのうちの2つは安定化が起こる結合性軌道で、残りの2つは不安定化が起こる反結合性軌道です。
不安定な軌道になるにつれて、節の本数は増加していきます。
基底状態において、4つの電子は、すべて結合性軌道にあるので、相互作用する前よりも全体のエネルギーは小さくなります。
配座異性体の安定性
そして、先ほど2位と3位の炭素原子間の単結合は回転しにくいという話をしましたが、実際のポテンシャル図はこちらのとおりです。
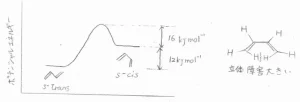
2つの二重結合が単結合(single bond)で結ばれているという意味で、一方をs-trans型、もう一方をs-cis型の立体配座と言います。
s-cis型では、2つの水素原子が近接しているため、その立体障害による不安定化が起こります。
その結果、s-trans型のほうが\(\displaystyle 12\ \rm{kJ\ mol}\)\(^{-1}\)だけポテンシャルエネルギーが低いことになります。
共役ジエンではないジエンとは
そして、共役ジエンには当てはまらないジエンの構造についても、お話ししておきます。
まず、アレン(または集積ジエン)と呼ばれる化合物があります。

これは、2つの二重結合が隣接した構造をもっています。
分子軌道図を考えると、中心の炭素が\(\displaystyle \rm{sp}\)\(\)混成の直線型となっており、その両端にある炭素原子とは、それぞれ\(\displaystyle \rm{p}\)\(_y\)軌道と\(\displaystyle \rm{p}\)\(_z\)軌道を使って\(\displaystyle \pi\)結合しています。

直交している軌道どうしでは相互作用できないため、この形状では電子の非局在化が起こりません。
そして、2つの二重結合の間にある単結合が2つ以上あるものも、共役ジエンとは言えません。

これは、\(\displaystyle \rm{sp}\)\(^3\)混成の炭素原子をはさんだことで、平面構造ではなくなるためです。
\(\displaystyle \rm{p}\)\(\)軌道どうしの距離も長いので、相互作用できません。
紫外-可視分光法
最後に、主に電子状態の遷移を調べるために用いられる紫外-可視分光法で、ここまで紹介してきたアルケンやジエンの結果がどのようになるのかお話しして終わります。
まず、この測定では、エタノールやメタノール、シクロヘキサンなどを溶媒として用います。これらは、測定する波長領域に吸収がない化合物です。
考えられる電子状態の遷移としては、まず結合性軌道から反結合性軌道への遷移があります。これを\(\displaystyle \pi-\pi^\ast\)遷移と言います。
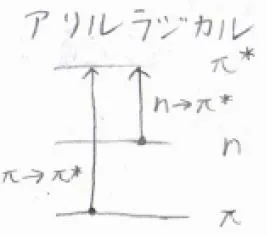
また、非結合性軌道から反結合性軌道への遷移は、\(\displaystyle \rm{n}\)\(-\pi^\ast\)遷移と言います。
吸収するエネルギーは、\(\displaystyle \pi-\pi^\ast\)遷移のほうが大きく、波長は短くなります。
非結合軌道と反結合性軌道では、軌道の重なりがないので、その吸収強度は小さくなります。
スペクトルの縦軸は、吸光度\(\displaystyle A\)を用います。吸光度は光の透過率の常用対数にマイナスを付けた値として定義されます。
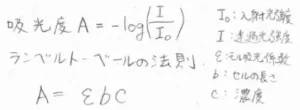
ランベルトベールの法則より、吸光度\(\displaystyle A\)はセルの長さ\(\displaystyle b\)と溶液の濃度\(\displaystyle c\)に比例します。すなわち、測定条件によって変わります。
物質固有な値となるのは、比例定数である\(\displaystyle \varepsilon\)で、これはモル吸光係数と呼ばれ、吸収強度の比較に用いられます。
下図は、実際の紫外スペクトルの例です。
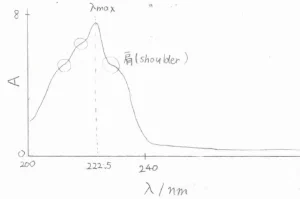
これは、2-メチル-1,3-ブタジエン、慣用名ではイソプレンと呼ばれる化合物についての結果です。
波長が\(\displaystyle 222.5\ \rm{nm}\)\(\)のところに大きなピークが観測されます。
大きなピークの両脇には、突起が見られることがあり、これは肩(shoulder)と呼ばれます。
こちらの表は、それぞれの化合物について、最も強度の大きな吸収が起こる波長である\(\displaystyle \lambda_\rm{max}\)\(\)とそのモル吸光係数\(\displaystyle \varepsilon\)を表したものです。

アルケンと非共役ジエンで吸収波長はほとんど変わりませんが、共役ジエンであるブタジエンになると、吸収波長は明らかに長くなっていることがわかります。
さらに長いtrans-1,3,5-ヘキサトリエンでは、さらに吸収波長は長くなります。
これは、容器が大きくなるほど、井戸型ポテンシャルの間隔が狭くなることと同じイメージです。
井戸型ポテンシャルについては、こちらの記事を参照してください。
そして、ブタジエンとイソプレンを比較すると、メチル基の超共役によってさらなる長波長シフトが起こっていることがわかります。
また、環状構造を有するシクロペンタジエンや1,3-シクロヘキサジエンでは、より平面構造を保ちやすくなるため、\(\displaystyle \rm{p}\)\(\)軌道の重なりが大きくなり、長波長シフトが起こります。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、X(https://X.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!