こんにちは!
今回も化学のお話やっていきます。
今回はテーマはこちら!
動画はこちら↓

動画で使ったシートはこちら(ether reaction)
では早速行きましょう!
Williamson合成法以外のエーテル合成法
Williamsonエーテル合成法については、こちらで解説しています。

無機酸を使ったエーテル合成法
この反応では、アルコール2分子に濃硫酸などの求核性が低い強酸を加えて加熱することで、このように対称エーテルが得られます。

例えば、アルコールが分枝をもたない第一級エーテルだった場合は、\(\displaystyle 130^\circ \rm{C}\)で\(\displaystyle \rm{S_N2}\)反応によりエーテルができます。

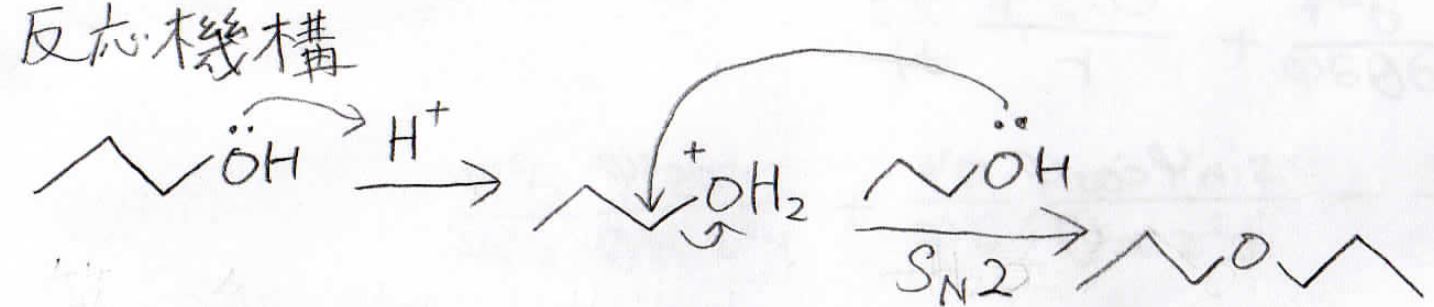
ただし、もっと高温の\(\displaystyle 180^\circ \rm{C}\)でやった場合はアルコールが活性になって\(\displaystyle \rm{E2}\)機構でアルケンが生成しますので、覚えておいてください。

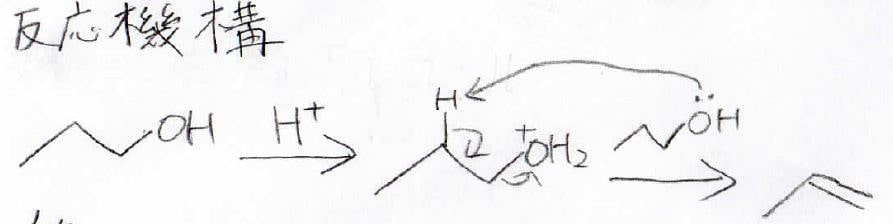
分岐があるエーテルになると、カルボカチオンの生成が有利になるので、\(\displaystyle \rm{S_N1}\)と\(\displaystyle \rm{E1}\)が進行します。
高温になるほど\(\displaystyle \rm{E1}\)が有利に起こるようになります。
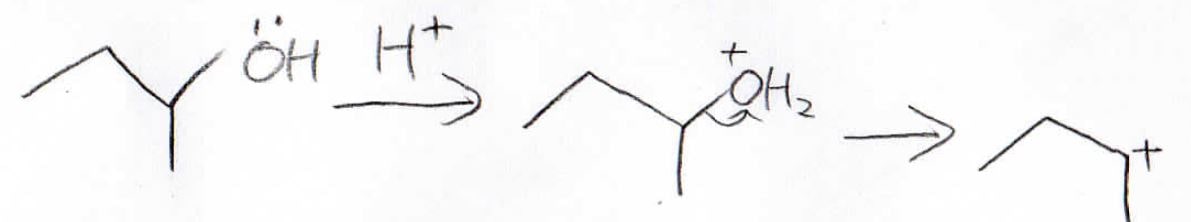
カルボカチオンを経由するということは、転位が起こる可能性もあるので注意してください。
加溶媒分解によるエーテルの合成
では今度、別の方法としてアルコールによる加溶媒分解を紹介します。
基質はハロアルカンやスルホン酸アルキルで、\(\displaystyle \rm{S_N}\)\(1\)機構によりエーテルが生成します。
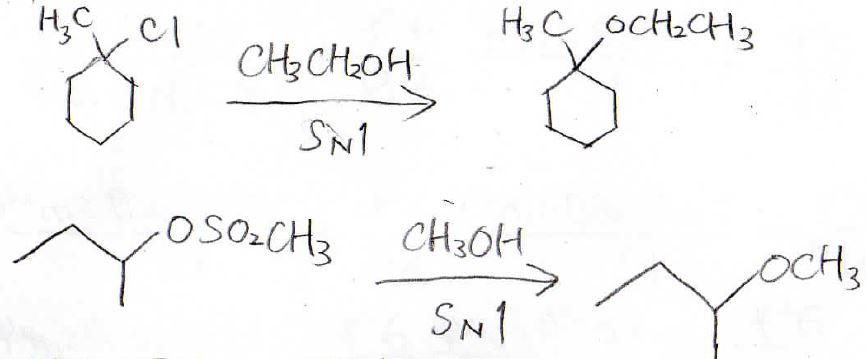
アルコールの加溶媒分解のことは、アルコリーシスとも言うので、知っておいてください。
エーテルの反応
では合成法はここまでにして、エーテルの反応を見ていきましょう。
空気酸化
まず、エーテルは空気によって酸化します。
この反応はラジカル的に進行し、エーテルヒドロペルオキシドやエーテルペルオキシドができます。
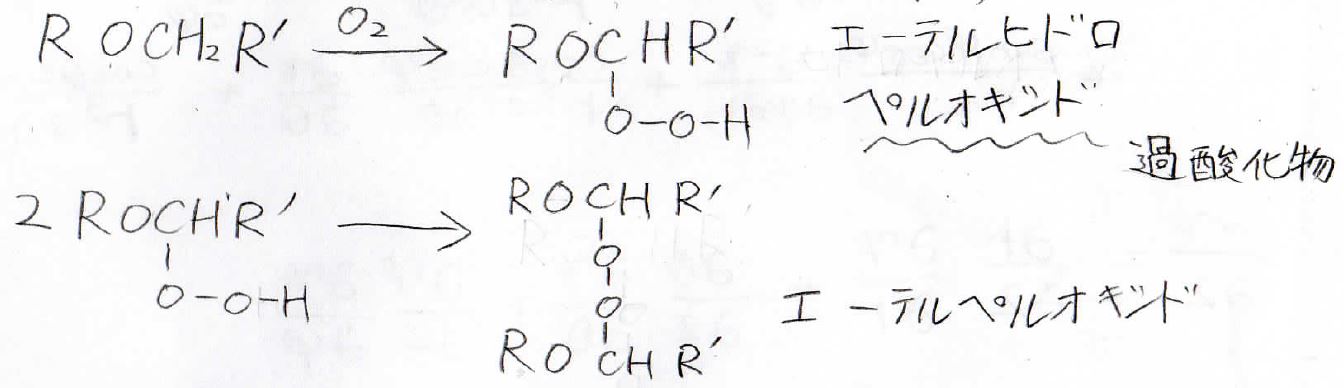
ペルオキシドというのは過酸化物という意味です。
この\(\displaystyle \rm{O-O}\)結合はかなり不安定で、ラジカル的に分解しやすいことが知られています。
その理由は、酸素原子上の孤立電子対が集中することで大きな静電反発が起こるからです。
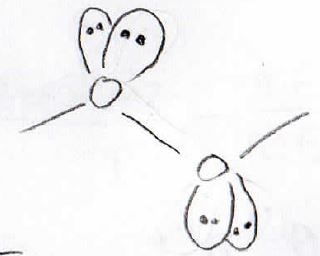
この分解は爆発的に起こるので、通常はエーテルを空気に数日間さらすということは行いません。
もし、空気にさらされているエーテルを見つけた際は、気を付けて対処しましょう。
強酸による開裂
強酸を使うとエーテルは開裂します。
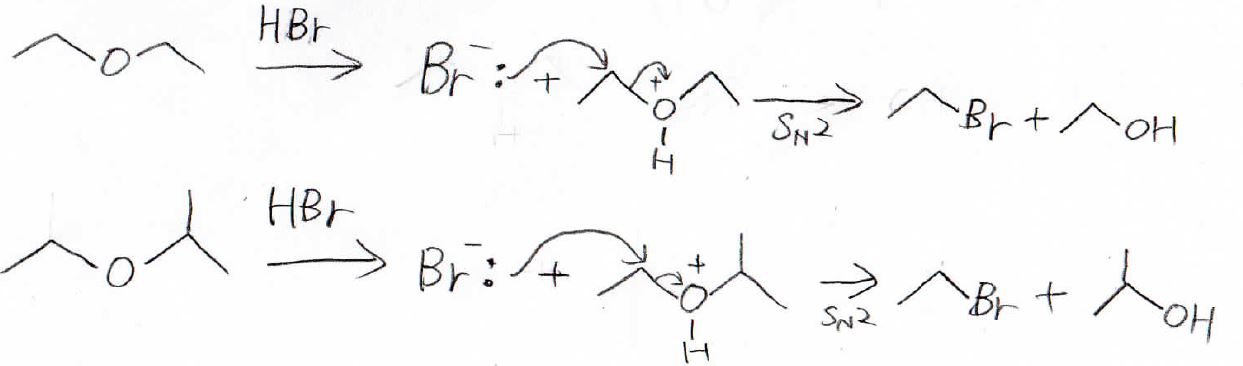
エーテルにハロゲン化水素を加えると、まず、酸素原子上の孤立電子対がプロトンに攻撃して、アルキルオキソニウムイオンができます。
ここにハロゲン化物イオンが求核攻撃することで、アルコールとハロアルカンができます。
仮に、エーテルが第一級アルキルと第二級アルキルをもっていた場合は、立体的に嵩高くない方の第一級炭素のほうが求核攻撃しやすいので、上のように第一級ハロアルカンと第二級アルコールが選択的に得られます。
ヒドロキシ基の保護
この開裂は、ヒドロキシ基の保護に使われます。
例えば、tert-ブチルエーテルは、希酸中で簡単にアルコールになります。
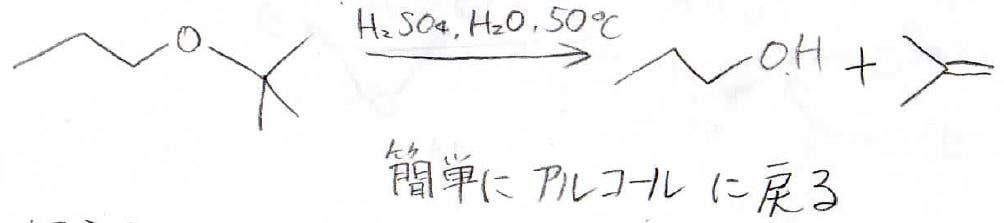
このエーテルを作るのも簡単なので、狙ってないアルコールの反応を防ぐことができます。
例えば、このようなハロアルコールからGrignard試薬を作ろうとすると、ヒドロキシ基にプロトン性の水素があるために、ここで消費されてしまって、アルキル化剤として思うように使うことができません。
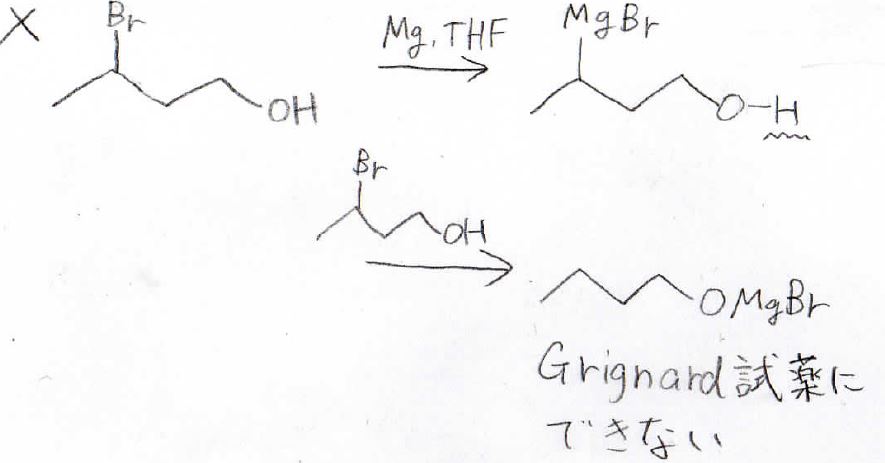
Grignard試薬については、こちらの記事で解説しています。

そこで、始めにtert-ブタノールによる保護を行って、プロトン性の水素がない状態で、Grignard試薬を作るという方法が有用になります。
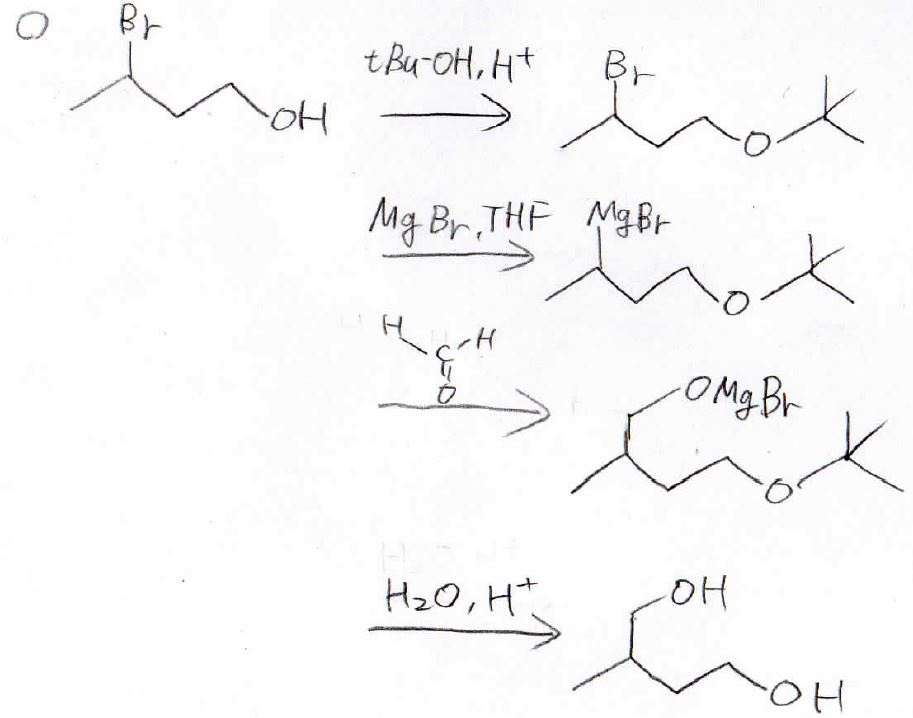
Grinard反応をさせた後、希酸によって加水分解すれば、ヒドロキシ基に戻すことができます。
練習問題
最後に、練習問題をやってみましょう。
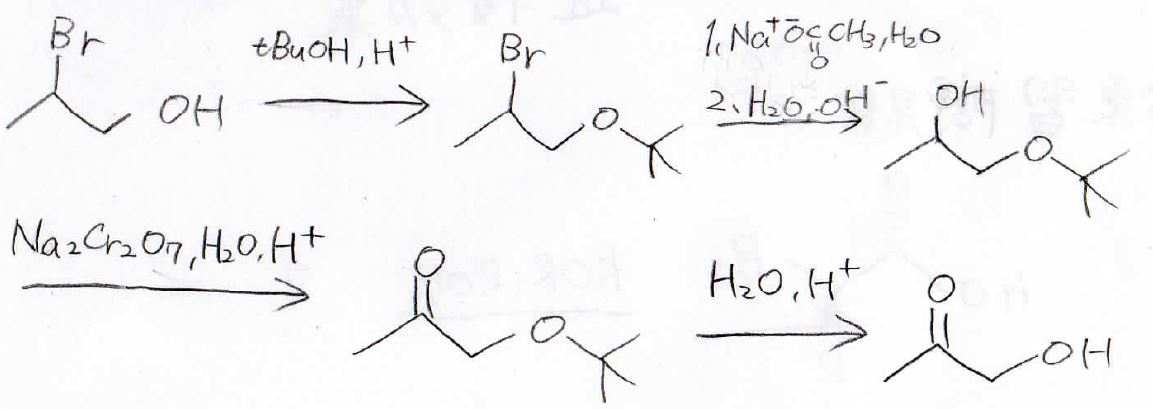
1つの分子内にカルボニルとヒドロキシ基をもったこの化合物、アセトールと呼ばれますが、これを2-ブロモ-1-プロパノールから合成する方法を考えてくださいす。
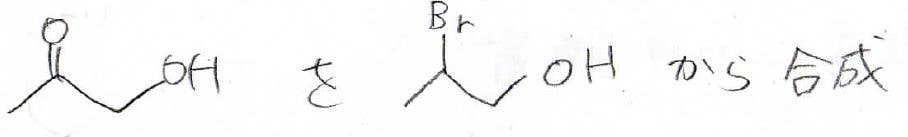
ケトンはアルコールの酸化で作れるのですが、この末端のヒドロキシ基を残したいので、tert-ブチルエーテルにして保護します。

それで酸化が起こる前のヒドロキシ基はブロモアルカンのエステル加水分解で作れます。
この反応は塩基性条件下なので、エーテルの開裂は起こりません。
アルコールの酸化、エステル加水分解についてもこちらで解説しています。

最後、これをひっくり返せば、このように合成戦略を立てることができます。
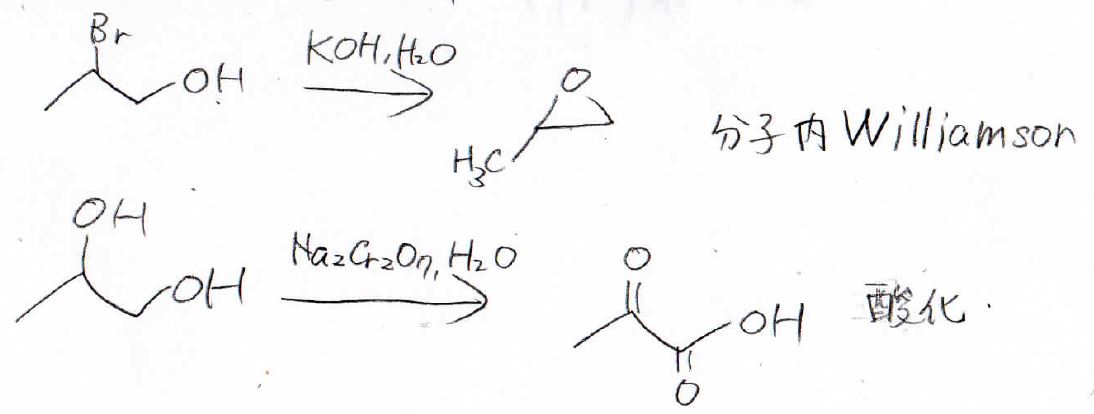
仮に保護をしていなかった場合は、このように分子内Williamsonや末端のヒドロキシ基の酸化が考えられるので、必ず保護しておきましょう。
まとめ
はい、今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!