こんにちは!
それでは今回も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(Williamson ether)
Williamsonエーテル合成法の一般式
ハロアルカンにアルコキシドが\(\displaystyle \rm{S_N2}\)機構で求核置換してエーテルが生成します。
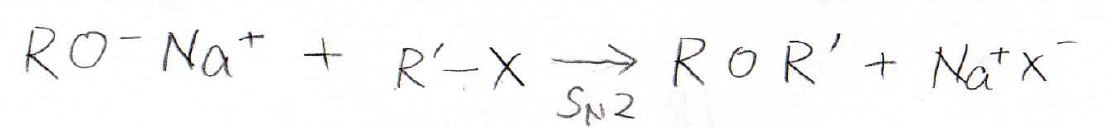
溶媒
溶媒にはアルコールを使うことができるため、アルコキシドの生成からスムーズに反応を起こせます。
ただし、ジメチルスルホキシド(DMSO)やヘキサメチルリン酸トリアミド(HMPA)などの非プロトン性極性溶媒を使ったほうが反応が速く進行する場合が多いです。

下記の反応なら1-ブタノール溶媒で14時間かかるのに対し、DMSOなら9.5時間で反応が完了します。
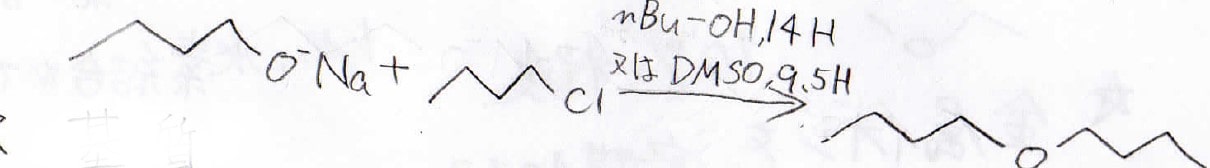
基質
基質に関して言うと、アルコキシドが強塩基であるため、立体障害のない第一級アルキル化剤以外だと結構な割合で\(\displaystyle \rm{E2}\)反応が起こります。
分子内Williamson合成法
分子内でこの反応が起こると、ハロアルコールから環状エーテルが生成します。
例えば、2-ブロモエタノールに強塩基を加えると、まずヒドロキシ基の水素がプロトンとして引き抜かれます。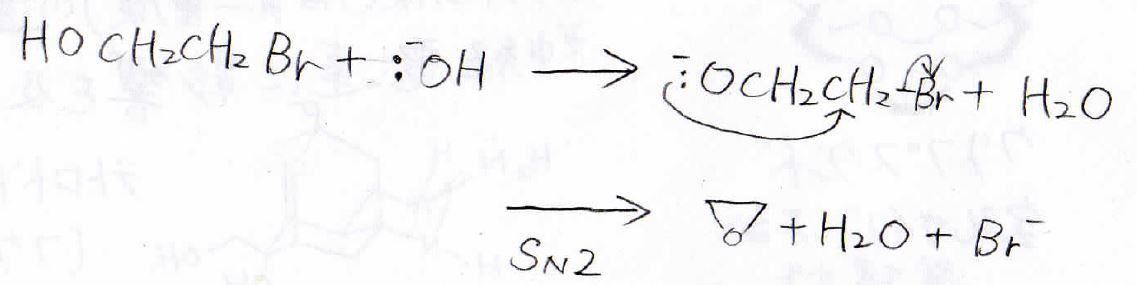
そして、求核的になった酸素原子がブロモと結合した炭素原子に攻撃することで、臭化物イオンの脱離とともに環状エーテルが生成します。
分子間反応との競合
ここで1つ疑問なのが、加えた塩基が求核攻撃することはないのかということです。
答えを言うと、この反応は起こり得ますが、環状エーテルができるほうが優勢です。
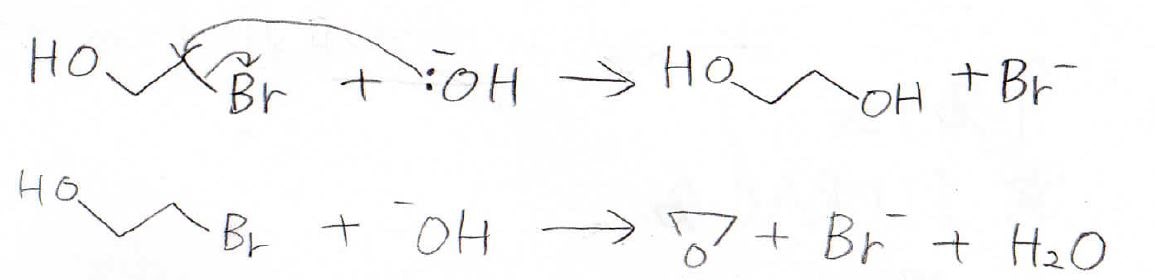
この分子間反応によってジオールが生成する場合と分子内反応によって環状エーテルができる場合の反応を見比べてみると、副生成物に水があるかどうかの違いがあります。
エントロピー的に考えれば、分子数が増加する反応のほうが起こりやすいことになるので、分子内反応が優勢になります。
速度論的に考えても、結合で繋がれている分だけ、求核剤とターゲットが常に近い状態にあるほうが遷移状態の構造との違いが少なくて、活性化エネルギーも低いと考えられるので、分子内反応のほうが有利であると考えられます。
以上より、熱力学的、速度論的、どちらの視点においても分子内反応のほうが有利であるということになります。
ちなみに、高希釈条件であるほど、塩基が近づきにくくなるので、ジオールの副生成物を減らすことができます。
環の大きさと反応速度の関係
実は、実験事実から反応速度定数の順番が下のようになることがわかっています。

ここで、\(\displaystyle n\)は環を構成する原子数で、\(\displaystyle k_n\)が\(\displaystyle n\)員環ができる際の反応速度定数を表しています。
三員環の生成が最も速く、続いて五員環、六員環、四員環と複雑な順番になっています。
これには、エンタルピーの寄与とエントロピーの寄与があると考えられています。
まずエンタルピー的には、遷移状態で大きな結合角ひずみエネルギーが生じるオキサシクロプロパンが最もできにくいことになります。
しかし、実際には三員環が最も速く生成するので、エンタルピーではこれを説明できません。
では今度、エントロピーで考えてみます。
ハロアルコールが長いほど、求核的な酸素と求電子的な炭素との距離が長いので、遷移状態に持ってくるときの原子の組み換えが大変になってきます。
短い方がとりうる原子の配置が少ないので、ボルツマンの式より、遷移状態に至ったときのエントロピー損失は小さくなります。
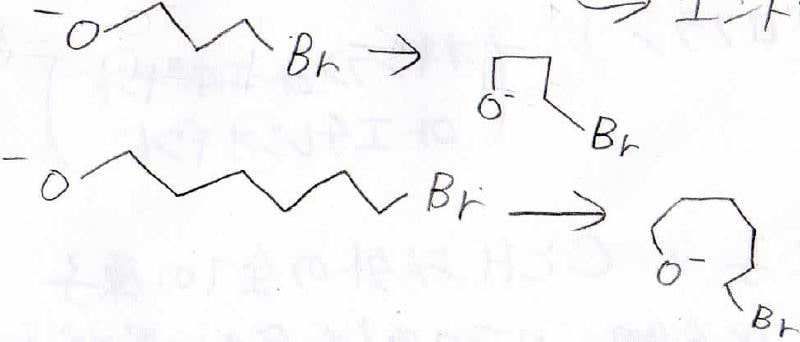
三員環が最も速くできるのは、このエントロピーの寄与が大きいためだと考えることができます。
ボルツマンの式については、こちらを参照してください。

ただし、遷移状態に至るまでのエントロピー損失だけでは、三員環の反応速度の説明として不十分ということで、特にオキサシクロプロパンの生成にのみ顕著に現れる第二のエントロピー効果があると言われています。
2-ブロモエトキシドの構造を見てみると、電子richな酸素原子と電子poorな炭素原子が非常に近い位置にあります。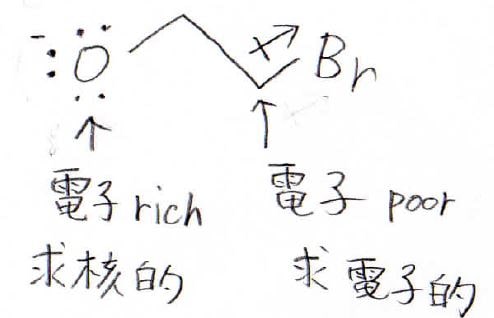
このときには、互いが近づくことで少しだけエネルギーの安定化が起こるため、最安定状態、すなわち基底状態においても、ある程度遷移状態に近い構造を持っていると考えられています。

これにより活性化エネルギーがさらに小さくなるので、オキサシクロプロパンの生成は速いことになります。
この効果は近接効果と呼ばれていて、四員環以上ではほとんど見られません。
練習問題
最後に、練習問題をやってみましょう。
下記の反応で生成するものを考えてください。

この反応では分子内Williamson合成の機構で、環状エーテルが生成します。
ただし、ここで気を付けたいのが立体構造です。
求核攻撃は\(\displaystyle \rm{S_N2}\)機構で進行するので立体特異的な反応になります。
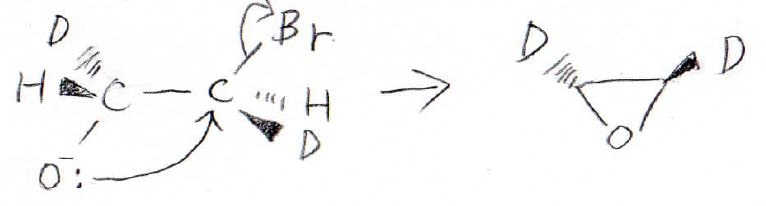
したがって、この場合の生成物は\(\displaystyle \rm{S_N2}\)の背面攻撃を考えると、上記のように光学活性なオキサシクロプロパンが生成します。
まとめ
はい、今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!