こんにちは!
それでは今回も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(first law of thermodynamics)
それでは、内容に入っていきます!
内部エネルギーの意味
まずは、内部エネルギーの意味について、少しお話しします。
化学の言葉で、考察の対象とする部分を表すときに、「系」という言葉を使いますが、内部エネルギーとは、その系内の全エネルギーを指します。
ここで言う全エネルギーとは、ポテンシャルエネルギーと運動エネルギーのことです。
絶対温度\(T\)における内部エネルギー\(U(T)\)は\(0 \rm{K}\)における内部エネルギー\(U(0)\)と温度に比例する熱運動のエネルギーの和で書けます。
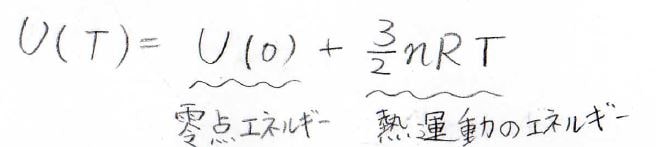
\(U(0)\)は零点エネルギーとも呼ばれ、これは量子力学によって説明されます。
一次元井戸型ポテンシャルを思い出してもらうと、ある空間に閉じ込めた量子には、最安定状態においても\(0\)ではないエネルギーの値がありました。
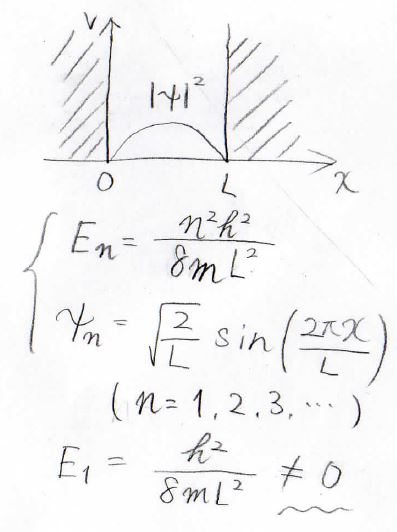
詳しくは、こちらの記事をご覧ください。

三次元の箱の中でも、これと同様に再安定状態のエネルギーが残ることになります。
それで、高校で習うときもそうなっていますが、多くの場合は、\(U(T)\)から\(U(0)\)を引いた、熱運動に帰属されるエネルギーだけを内部エネルギー\(U\)と表します。
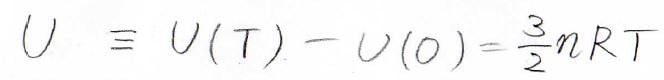
気体分子が並進エネルギーしかない場合には、\(U=\frac{3}{2}nRT\)となり、扱いやすくなります。
内部エネルギーが変化する要因
では続いて、内部エネルギーを変化させるにはどういう方法があるのかというのを考えてみます。
熱量
その方法は2種類がありまして、まず1つ目は熱です。
系の外から熱を与え、分子の温度を上昇させます。
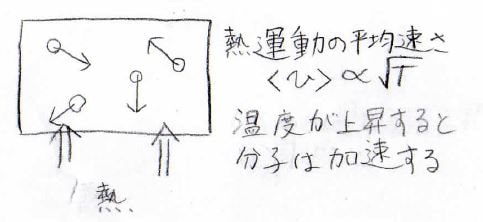
気体分子運動論やマクスウェル-ボルツマン分布で導かれるように分子の平均の速さは、絶対温度のルートに比例します。
つまり、温度が上昇するということは分子の運動が速くなることと同じであり、内部エネルギーも温度に比例するので増大します。
詳しくは、こちらを参照してください。
仕事
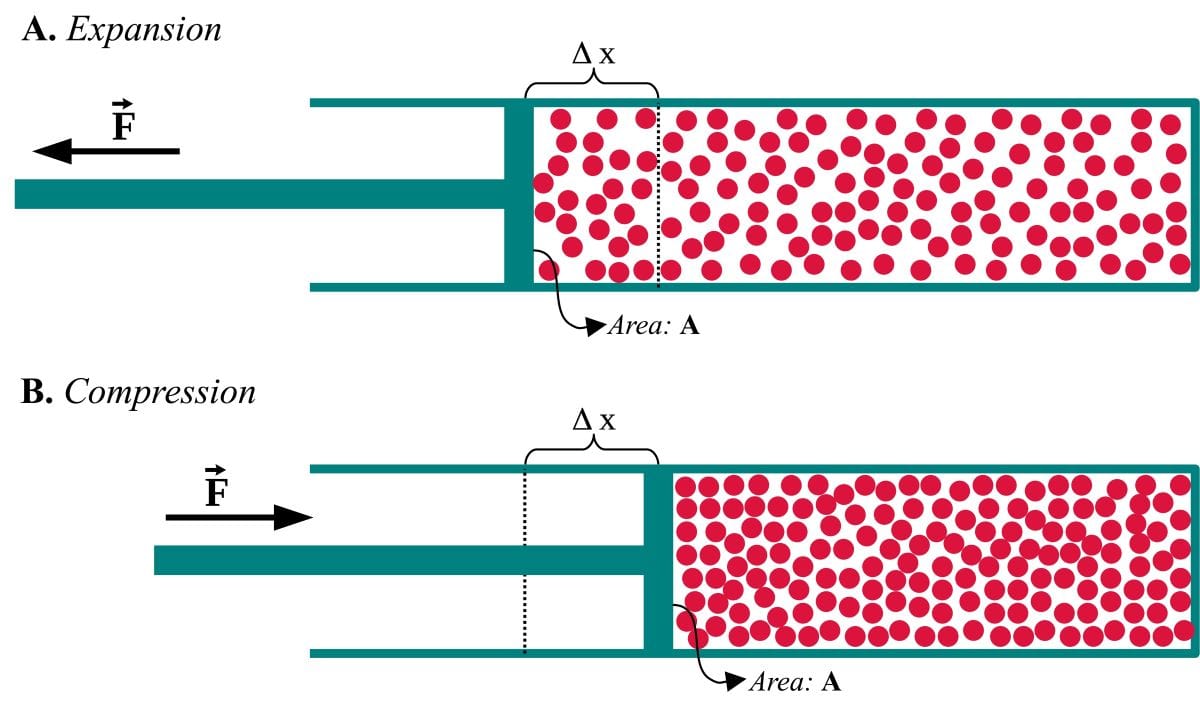
そして2つ目の方法は、仕事です。
例えば、系の外から上方向へ力が与えられ、系の体積が変化したとします。
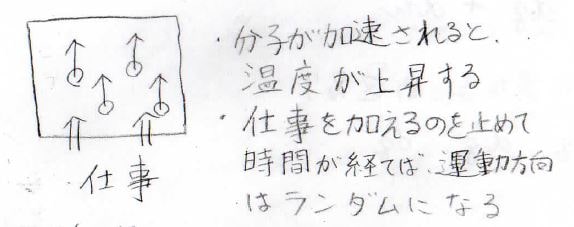
仕事をされている最中と終わった直後には、分子が壁から一方向への力を受けることで、上方向へ加速します。
熱を加えた時の逆で、この場合は分子が加速されるということが、温度の上昇と同じになり、内部エネルギーの増大も起こるということになります。
ちなみに、仕事をするのをやめて少し時間がたてば、分子同士の衝突により、運動の方向はまたランダムになります。
熱力学第一法則
そして、ここまでの説明を式にすると、次のようになります。

内部エネルギーの変化量\(\Delta U\)は、系に与えられた熱量\(q\)と系がされた仕事\(w\)の和で表せます。
これは熱力学第一法則と呼ばれ、熱力学の重要なルールの1つになります。
この式から言えることは、まず孤立系、すなわち外部から熱も加えられず、仕事もされない場合には、内部エネルギーは一定になります。
熱量や仕事はエネルギーと同じ単位を持ちますが、エネルギーと全く同じものではなく、エネルギーが動くときの形のことを指します。
例えば、食べ物の熱量は何\(\rm{kcal}\)と言いますが、あれは食べ物を分解することで発生する熱量のことで、人に外部から与えられるエネルギーの大きさを指しています。
そして、この第一法則は、第一種永久機関ができないということも示しています。
第一種永久機関とは、外部から熱も仕事も加えることなく、外部へ仕事をしてくれる装置のことです。

これが実現できれば、化石燃料のエネルギー問題は一切発生しない夢の機械ですが、残念ながらこの第一法則により、実現不可能であることが否定されてしまいました。
ちなみに、第二種永久機関というのもありまして、これは第一法則に反しないように、装置の中で仕事をする部分を組み入れたものになります。
またお話ししますが、これは熱力学の第二法則より、仮に作れたとしても役に立たず、エンジンなどのような使い方は否定されています。
状態量と非状態量
はい、それでは最後、状態量という言葉を紹介しておきます。
状態量というのは、系の状態だけで一意的に決まる量のことを言います。
それはつまり、過去の履歴や変化の経路には依存しない量とも言い換えることができます。
グラフで説明すると、ある温度\(T_1\)の理想気体が\(p\)-\(V_\rm{m}\)グラフ上の点Aにあったとします。

そこから温度\(T_2\)の点Bへ変化させるとき、①と②の2通りの経路を通ったとします。
その時、内部エネルギーの変化量は温度によって決まるため、①でも②でも同じ値になります。
しかし、気体に与えられた熱量や仕事は同じにならず、経路に依存します。
この時、\(U\)は\(p\)と\(V_m\)という状態を表す物理量の関数とみることができるため、状態関数とも言います。
逆に\(p\)や\(V_m\)も\(U\)の関数となります。
そして、\(p\)や\(V_m\)だけでは、その値が決まらず、変化の経路に依存する熱量や仕事は経路関数と呼ばれます。
それで熱力学では、微小変化量を使って考えることが非常に多いのですが、その時にこの状態量と非状態量を明確に区別します。
例えば、内部エネルギーの微小変化量\(dU\)は

という具合です。
\(d’\)や\(\delta\)と書く場合もあります。
れからの動画の中で、こうやって書きますが、なぜ\(d\)と書かないのかというのを、ぜひここで理解しておいてください。
まとめ
それでは今回の内容は以上なので、最後おさらいをやって終わります。今回は熱力学第一法則についてお話ししました。
その法則とは、内部エネルギーの変化量は系に与えられた熱量と系にされた仕事の和になるというものです。
内部エネルギーは系内の全エネルギーのことで、多くの場合は零点エネルギーを基準にした、熱運動のエネルギーになります。
系の状態によって一意的に決まる量を状態量と言いまして、内部エネルギー、そして温度やモル体積、圧力がそれに当たります。
これらは互いに関係しているため状態関数とも呼ばれます。
これに対して、熱量や仕事は変化の経路に依存するため、経路関数と呼ばれ、微小変化量を表す際には明確に区別されます。
内容は以上です。どうもありがとうございました!