こんにちは!
求核置換反応と脱離反応を勉強していると、ハロゲンの求核性や塩基性が混同してくることがあるので、いったんハロゲンに絞ってまとめてみることにしました。
混乱してきたらぜひここに戻ってきてください!
動画はこちら↓
動画で使用したシートはこちら(halogen)
ハロゲンとは
ハロゲンとは第17族元素のことで、周期表の上から順に、フッ素、塩素、臭素、ヨウ素、アスタチン、テネシンが当たります。
アスタチンとテネシンは、他の4つと比べてかなり特殊で、ほとんど有機合成に使うことはないため、軽く触れるだけにします。
アスタチンは原子番号85、テネシンは原子番号117の元素です。
アスタチンとテネシンに安定な同位体は存在せず、半減期も短いです。
鉄や鉛が安定な元素だという話を聞いたことがあるかもしれませんが、これらは鉄や鉛よりずっと大きいので、壊変を繰り返して鉄や鉛に近い安定な核種になろうとします。
また一般的に、このように大きな元素は、金属でなくても金属のような性質をもちます。
これは、原子核の正電荷が内核側の電子に遮蔽されることで、外殻側の電子が原子核の拘束を受けにくくなり、自由電子のようにふるまうためです。
そのため、この2つはハロゲンでありながら、例えば、陽イオンもある程度安定して存在するということが予想されます。
F、Cl、Br、Iの性質
ここからは、有機合成にもよく使われているフッ素からヨウ素までのハロゲンについて、物性を比較していきましょう。
単体は有色
まず、これらに共通する特徴として、単体の二原子分子に色がついています。
フッ素は淡黄褐色気体、塩素は黄緑色の気体、臭素は赤褐色の液体、ヨウ素は黒色の固体です。
ヨウ素は昇華性で、昇華点で紫色の気体になります。
1価の陰イオンになりやすい
電子を1個受け取ることで希ガスと同じ電子構造となり安定となるため、ハロゲンは1価の陰イオンになりやすいです。
以下は、大学の知識です。
Fの特異性
下の表は、各原子のファンデルワールス半径を比較したものです。
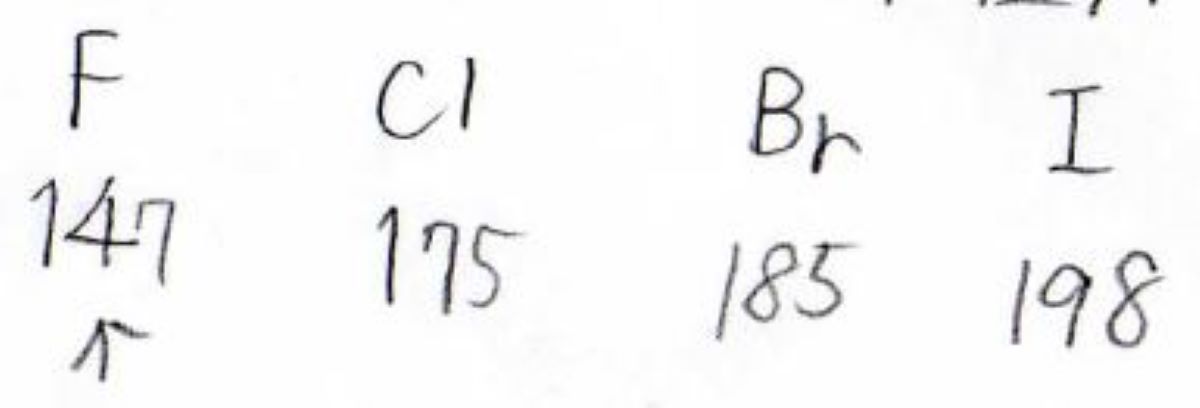
ファンデルワールス半径は、簡単には原子の大きさの指標だと考えてください。
単位は\(\rm{pm}\)です。
これによると塩素、臭素、ヨウ素が\(10\ \rm{pm}\)ずつ大きさの差があるのに対して、フッ素は\(147\ \rm{pm}\)と塩素の\(175\ \rm{pm}\)に比べても、明らかに小さいことがわかるかと思います。
フッ素原子の小ささは、ハロゲン化水素の物性に大きな影響を与えています。
例えば、塩化水素の水溶液、塩酸は強酸です。
臭化水素の水溶液である臭化水素酸は、塩酸よりも強い酸で、ヨウ化水素酸はもっと強い酸です。
ここまでくると、ハロゲン化水素はすべて強酸なのかなと思いますが、フッ化水素酸は弱酸です。
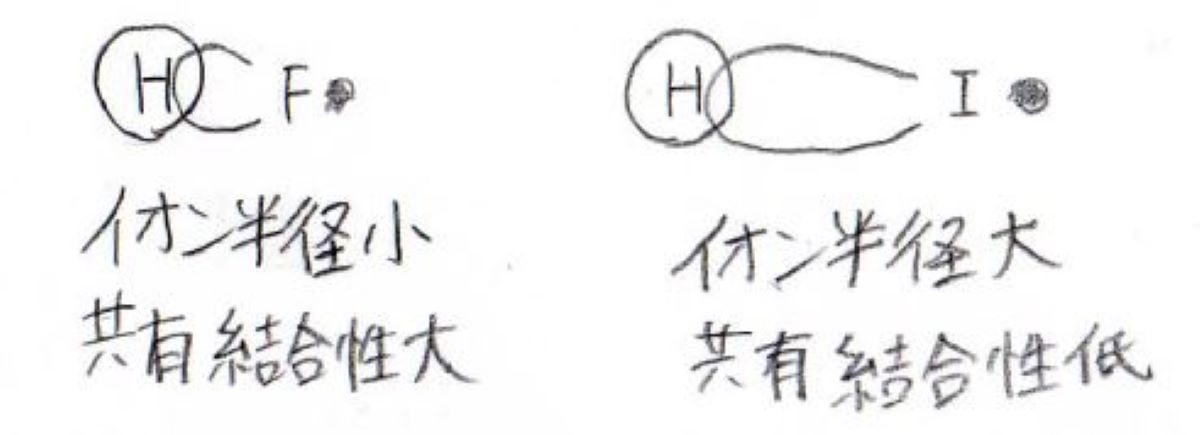
フッ化水素とヨウ化水素の軌道の重なりを見ると、フッ化水素はハードとハード、ヨウ化水素の場合はソフトとハードの組み合わせなので、フッ化水素のほうが共有結合性が高く、ヘテロリシス開裂しにくいといえます。
イオンの解離を考えても、フッ素のほうがかなり小さいので、プロトンとの間ではたらく静電引力が大きく、分子の形が安定になります。
また、フッ化水素以外のハロゲン化水素は、沸点がマイナス何十度で、常温常圧条件下で気体であるのに対し、フッ化水素の沸点は\(19.5^\circ \rm{C}\)であるので、室温から少し冷やせば液体になります。

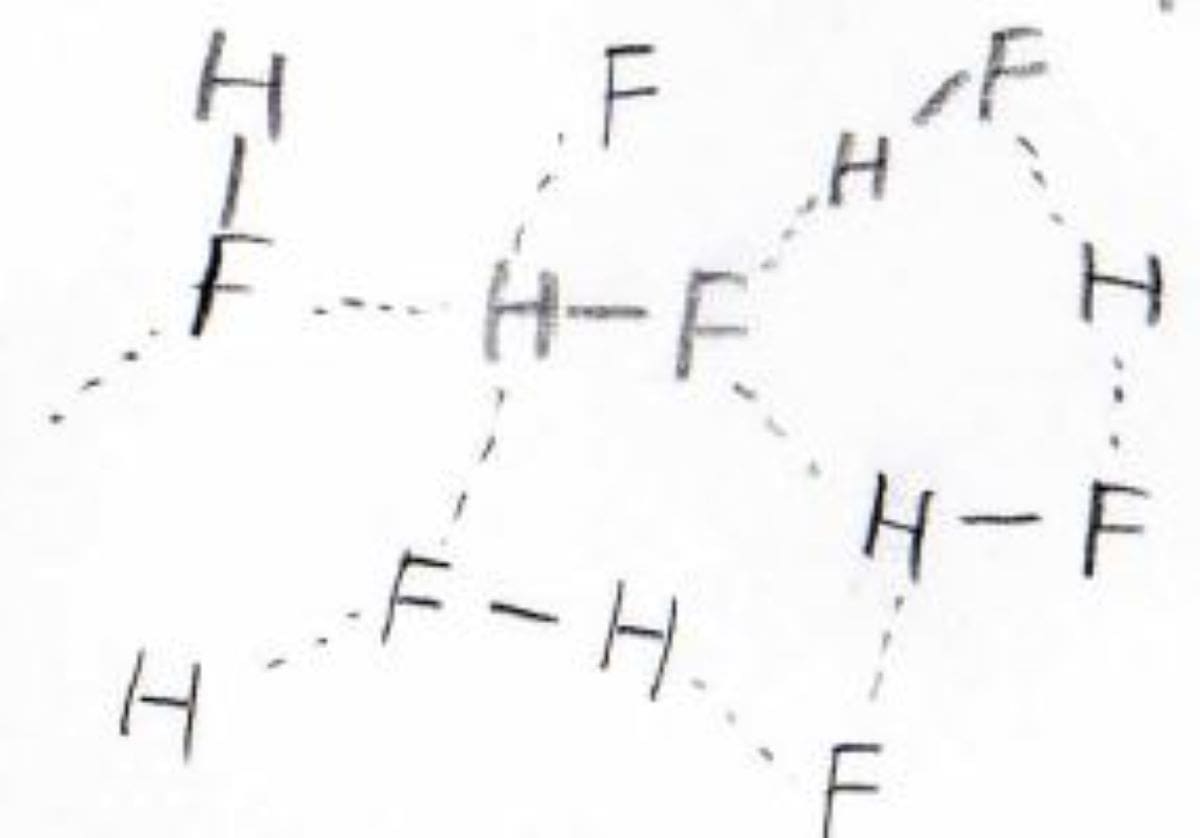
この沸点の高さの理由は、水素結合にあります。
フッ素、酸素、窒素は水素結合を形成するので、分子間距離の小さい液体が熱力学的に安定となり、沸点が高くなります。
硫化水素に対して水の沸点が高いのも同じ理由で、水素結合がなければ、水は常温で気体として存在していたはずです。
ハロゲンの反応性の順番
最後に、有機化学で重要となるハロゲンの反応性の順番を整理しておこうと思います。
塩基性
\(\displaystyle \rm{F^-\gt Cl^-\gt Br^-\gt I^-}\)
フッ化物イオンが飛び抜けて高いです。
共役酸のフッ化水素が弱酸なので、共役塩基のフッ化物イオンは強塩基で、それ以外は弱塩基ということになります。
アルカンのラジカル的ハロゲン化
\(\displaystyle \rm{F_2\gt Cl_2\gt Br_2\gt I_2}\)
これもフッ素が一番大きいです。
ハロゲン化水素の形成によるエネルギーの安定化が、この反応を進めるのに大きな寄与をしています。
さらに補足すると、フッ素原子はその小ささゆえ、孤立電子対間の静電反発が大きいため、\(\displaystyle \rm{F-F}\)結合は不安定になります。
そのため、ラジカル連鎖反応の開始もフッ素が一番速いことになります。
脱離能
\(\displaystyle \rm{F^-\lt Cl^-\lt Br^-\lt I^-}\)
これはヨウ化物イオンが一番大きいです。
\(\displaystyle \rm{C-I}\)間の結合は、分子間距離が大きいので分極が大きく、イオンとして解離しやすいことになります。
一方で\(\displaystyle \rm{C-F}\)結合は、共有結合性が大きくほとんど解離しません。
ハロゲン化物イオンの求核性
これは溶媒によって順番が真逆になるので混同しやすいところです。
しっかり押さえておきましょう。
1. プロトン性溶媒
\(\displaystyle \rm{F^-\lt Cl^-\lt Br^-\lt I^-}\)
プロトン性溶媒では、イオン半径が小さいイオンほど多くの溶媒分子からのプロトン供与により安定化します。
いわゆる溶媒和です。
ヨウ化物イオンが最も溶媒和の効果を受けないので、最も弱塩基でありながら一番強い求核剤となります。
2. 非プロトン性溶媒
\(\displaystyle \rm{F^-\gt Cl^-\gt Br^-\gt I^-}\)
一方、ジメチルホルムアミドなどの非プロトン性溶媒では、塩基性が高いほど求核性が大きいという一般的な傾向のとおりにフッ化物イオンが最も大きい求核剤となります。
試験で出されるときは、プロトン性溶媒の問題が多いと思うので、ヨウ素が最も強い求核剤で最も脱離能が大きい脱離能になるということを理由を含めて説明できるようにしておきましょう。
まとめ
はい、今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!




