こんにちは!
それでは今日も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(real phase diagram)
それでは内容に入っていきます!
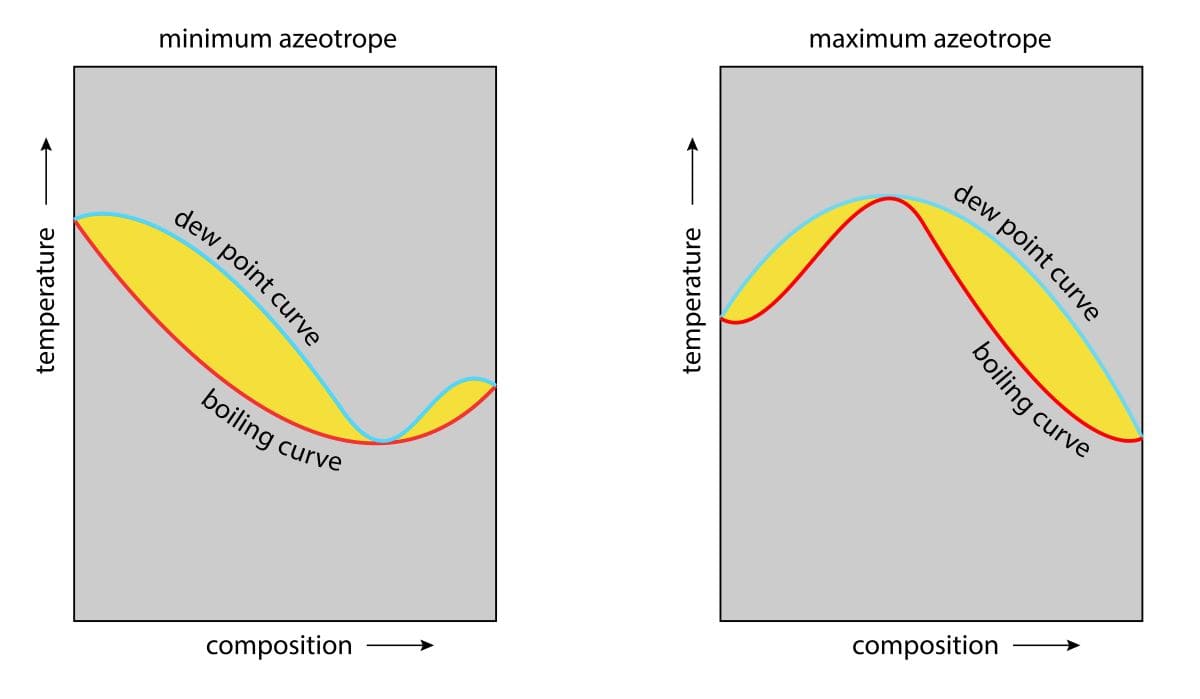
溶液と混合気体の平衡を表す温度組成図
理想溶液と理想気体
まずは、2成分(\(\rm{A}\)と\(\rm{B}\))の混合系で、理想溶液と理想気体の平衡状態について、温度-組成図をおさらいします。
導出の過程は、前回の記事を参照してください。

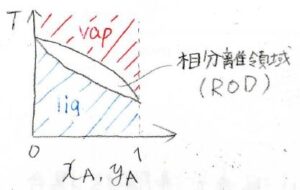
横軸が、液相の組成\(x_\rm{A}\)と気相の組成\(y_\rm{A}\)、縦軸が温度\(T\)です。
グラフの上側が気相、下側が液相です。
どちらの相も存在できない温度と組成の領域が存在し、これを相分離領域、略してRODと呼びます。
以降が新しい内容です。
引力相互作用が優勢なとき
まず、\(\rm{A}\)-\(\rm{B}\)間で引力相互作用が優勢である場合を考えます。
このときには、高い温度でも、より分子間距離が短い液体であろうとする傾向が現れます。
その結果、相図において液相の領域が拡大することになります。
これが、その相図の概形です。
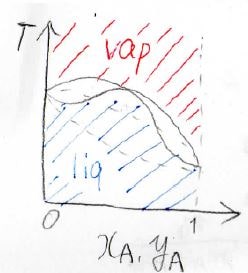
点線が理想系で、実線が実在系です。
RODが真ん中あたりでへこんだ形になります。
引力相互作用の程度によっては、液相と気相の曲線が接することがありますが、常に接するわけではありません。
このとき、過剰ギブズエネルギー\(G^\rm{E}\)は負になります。
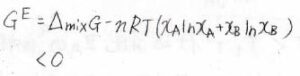
斥力相互作用が優勢なとき
続いて、\(\rm{A}\)-\(\rm{B}\)間で斥力相互作用が優勢な場合について考えます。
先ほどと反対に、低い温度でもより分子間距離が長い気体が相対的に安定となります。
その結果、グラフ上で気相の領域が拡大することになります。
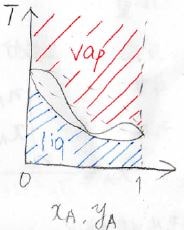
このとき、過剰ギブズエネルギーは正の値をとります。
共沸
そして、気相と液相の2つの曲線が接する場合は、理想系では起こらない現象が起こります。
例えば引力優勢の場合、すべて液体の状態から温度を上昇させると、ある温度で一部が気体になります。
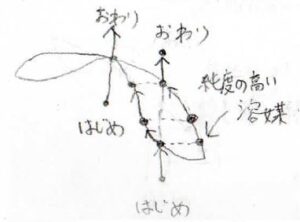
この気体は、もとの溶液よりも溶媒の濃度が高くなります。
さらに温度を上げると、それぞれの点はグラフの左上にシフトしていき、気相の組成が仕込み比と一致したときにすべて気体になります。
しかし、仕込み比が接点の組成と同じときには、平衡状態にある液相と気相の点が重なってしまうので、液相と気相の組成は等しくなります。
こうなると、蒸留によってより純度の高い溶媒を取り出すということができなくなります。
この現象を共沸といいます。
接点の組成を共沸組成といい、共沸組成の混合物のことを共沸混合物といいます。
下のグラフは斥力相互作用が優勢で、かつ仕込み比が共沸組成よりもグラフの左側にあったときです。
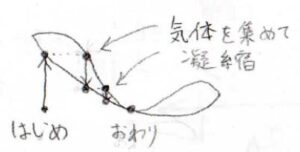
温度を上げていって発生した気体を凝縮し、それをさらに蒸発させることで、仕込み比よりも溶媒の濃度を高めることができます。
しかし、その組成が共沸組成まで到達すると、これ以上純度の高い溶媒を集めることが不可能になります。
この場合は、別の分離方法をしないといけません。
液-液相分離
そして、先ほどの相図では考えていなかったのですが、\(\rm{A}\)-\(\rm{B}\)間で斥力相互作用が優勢にはたらく場合は、液相が2相に分離することがあります。
液相が相分離する系の相図は、このような形になります。
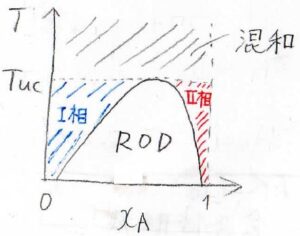
実際の系では、ニトロベンゼン/ヘキサン系やパラジウム/水素系でこのような相図が見られます。
青いところが\(\rm{B}\)を多く含む相で、赤いところが\(\rm{A}\)を多く含む相です。
いま、それぞれをI相、II相と呼ぶことにします。
蒸発や分解を考えない場合、2相に分離している状態から温度を上げていくと、ある温度以上で混和します。
これは、正則溶液を例に説明すると、次のとおりになります。
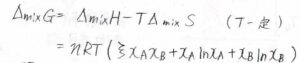
混合エンタルピーは、異種分子間相互作用と同種分子間相互作用の差に対応するため、両方の成分の個数に比例すると考えられます。
その比例定数はエネルギーの次元をもつので、それを熱エネルギーの大きさ\(RT\)で割って、無次元量\(\xi\)を相互作用パラメータとしていました。
注意してほしいのは、混合エンタルピーが必ず温度に比例するというわけではないということです。
あくまで無次元量で相互作用を表現するために、\(RT\)を使っているだけだということです。
仮に分子間相互作用が温度によって変化しないときには、分子数に対する比例定数の\(\xi RT\)が定数になるため、\(\xi\)は\(T\)に反比例します。
そして、ある温度以上では\(\xi \leq 2\)となり、相分離が起こらなくなります。
相分離が起こらなくなる温度のことを上部臨界溶解温度と呼び、ここでは\(T_\rm{uc}\)と表すことにします。
温度\(T\)が\(T_\rm{uc}\)より低いときに相分離しますが、これを部分可溶という言い方もします。
\(T\)が\(T_\rm{uc}\)よりも高いときの混和状態は、全域相溶と言います。
上部臨界溶解温度といっていたように、実は下部臨界溶解温度がある混合系も存在します。
その場合の相図は、このような形になります。
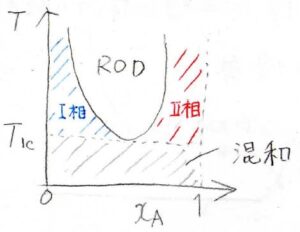
いま、下部臨界溶解温度を\(T_\rm{lc}\)と表すことにします。
実際の系では、水/トリエチルアミン混合系でこのような相図になることが知られています。
\(T_\rm{lc}\)よりも低い温度では、詳しい様相はわかっていませんが、水素結合により会合体を形成し安定化することで、全域相溶となります。
\(T_\rm{lc}\)よりも高い温度では、会合体が解離し、部分可溶となります。
また、水/ニコチンの混合系は、上部と下部両方の臨界溶解温度をもちます。
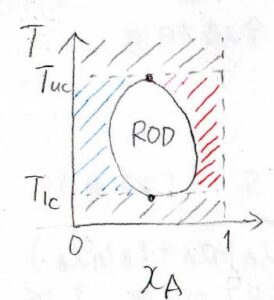
その場合、こちらのように、RODの穴が開いた相図になります。
部分可溶な液体の蒸留
それでは最後に、部分可溶な液体の蒸留を考えてみます。
液体の沸騰が起こるよりも低い温度で全域相溶となる場合は、相図はこちらのような形になります。
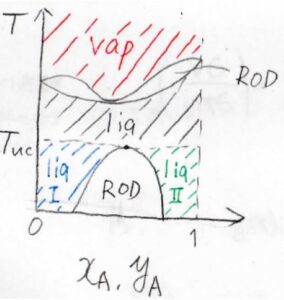
上部臨界溶解温度より低い温度で液相2相状態、上部臨界溶解温度より高く、溶液の沸点より低い温度で液相1相状態、もっと高い温度で気相1相状態となります。
それで、全域相溶となるよりも低い温度で先に沸騰が起こる場合は、こちらの相図のように、RODが合体します。
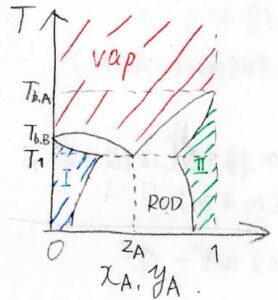
このとき、気相がとりうる最も低い温度(\(T_1\))をとる点の組成を仕込み比\(z_\rm{A}\)とした混合物は共沸混合物となります。
液相は相分離したまま、沸騰が起こりますが、液相全体の組成と気相の組成は同じになります。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!