こんにちは!
今日も化学のお話しをしていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(resonance)
ではさっそく本題に行きましょう!
共鳴の例
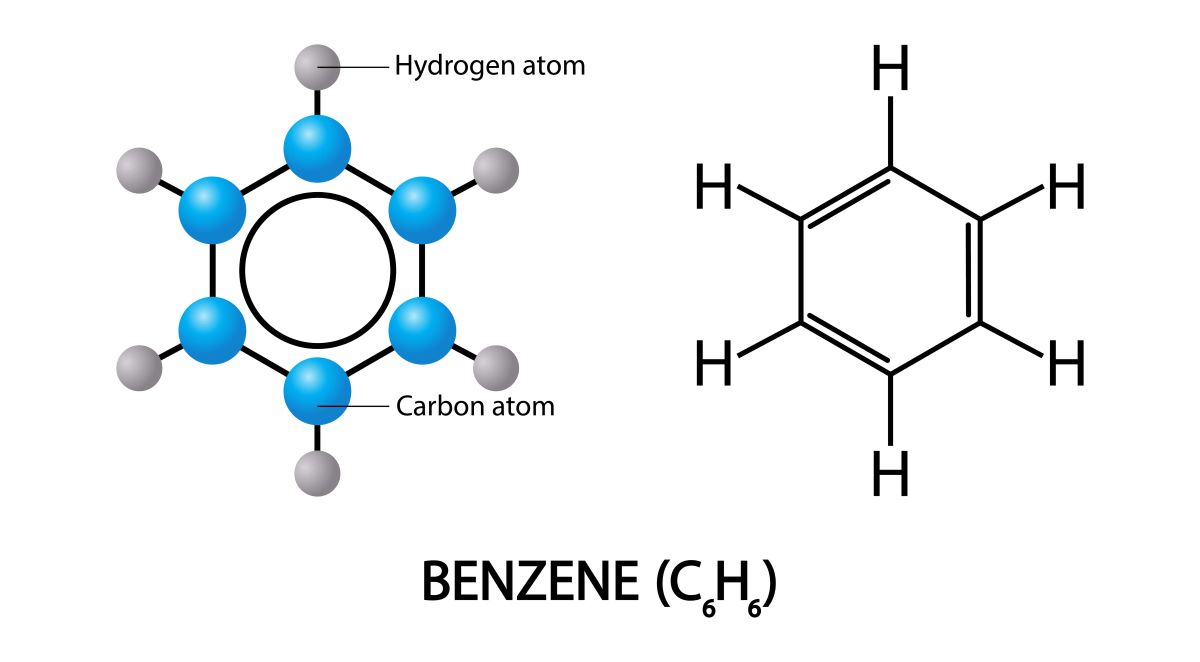
共鳴を説明する前にまず、ベンゼンの構造を頭に思い浮かべてみてください。
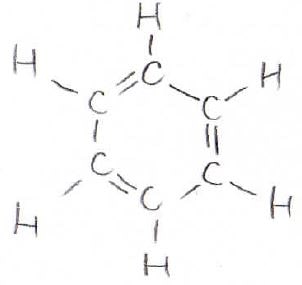
高校では、上記のように炭素6個の環状化合物で単結合と二重結合が交互になっているという説明をされた方も多いと思います。
しかし、実はここに書いた構造は厳密にはベンゼンの構造を表したものではありません。
単結合の結合長が\(15.3\ \rm{nm}\)、二重結合の結合長が\(13.4\ \rm{nm}\)であるので、この環状化合物は短い辺3本と長い辺3本でできた六角形となるはずですが、実際に観測されるベンゼンは正六角形分子です。
どの結合も等価であり、その結合長は\(14.0\ \rm{nm}\)で、単結合と二重結合の間の長さになっています。
ここで起こっている現象こそがこの動画のテーマである、共鳴という現象です。
共鳴とは
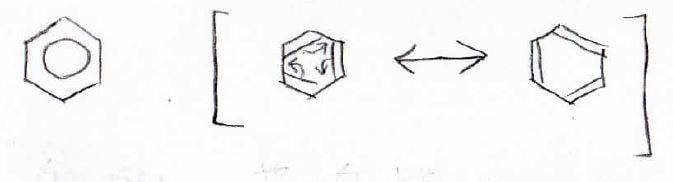
記号では、両矢印\(\leftrightarrow\)を使って表します。
\(\rightleftharpoons\)だと化学平衡の矢印になるので、混同しないようにしてください。
電子は原子に原子核に比べて、とても軽いため、交換のスピードに大きな差があります。
電子が特定の結合に局在化することなく、素早く軌道間を行き来することで、その中間の構造が観測されます。
量子として考えれば、1個分の電子雲が広く分布しているイメージです。
広く分布したほうが静電反発が小さくなるため、一般的には、共鳴構造を多く書ける化学種ほど熱力学的に安定となります。
この効果は共鳴効果、共鳴安定化と呼ばれます。
ただし、一概にそう言えるわけではなく、各々の共鳴構造が全体の安定性に寄与するので、不安定な共鳴構造がないほうが安定となります。
また、このような電子の交換は同一平面上で起こります。
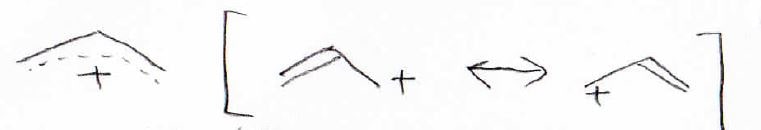
例えば、上記のアリルカチオンは、すべての炭素が\(\displaystyle \rm{sp}\)\(^2\)混成軌道で\(\displaystyle \sigma\)結合を作っています。
そのため、すべての原子中心が同一平面上にあります。
その平面に対して垂直方向には、\(\displaystyle \rm{p}\)軌道があります。
3つの炭素原子の原子軌道である3つの\(\displaystyle \rm{p}\)軌道を、2つの電子が非局在化して分布することになります。
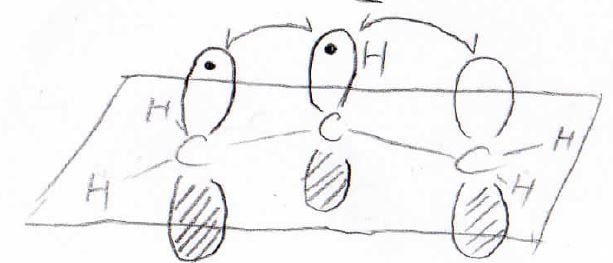
このように移動できる電子のことは\(\displaystyle \pi\)(パイ)電子といい、\(\displaystyle \pi\)電子が占める軌道のことを\(\displaystyle \pi\)軌道と言います。
分子の中で\(\displaystyle \pi\)電子が非局在化している部分のことを\(\displaystyle \pi\)電子共役系と言います。
共鳴で不安定化する例
最後に、共鳴構造を取ることで不安定になってしまうものがあるので、それを紹介します。
ベンゼンのように環状化合物で、二重結合がたくさんある分子構造、共鳴構造をもつ化合物は環状ポリエンもしくはアヌレンと呼びます。
ポリというのは、たくさんという意味です。
この環状ポリエンは、\(\displaystyle \pi\)電子の個数によって、共鳴構造をとったほうが安定かどうかが変わります。
その法則はヒュッケル則と言います。
ヒュッケル則によると、\(\displaystyle n\)を自然数として、\(\displaystyle \pi\)電子の数が\(\displaystyle 4n+2\)個のときに、\(\displaystyle \pi\)電子の非局在化で安定な構造となります。
ベンゼンは\(\displaystyle \pi\)電子の数が6個なので、共鳴安定化しています。
そしてこのように、共鳴安定化できる環状ポリエンのことは芳香族と呼ばれます。
対して、例えばシクロブタジエンのように\(\displaystyle \pi\)電子の数が\(\displaystyle 4n\)になった場合は、共鳴構造をとることで不安定になります。
そのためシクロブタジエンは正方形分子ではなく、長方形分子として観測されます。
このような環状ポリエンのことは反芳香族と言います。
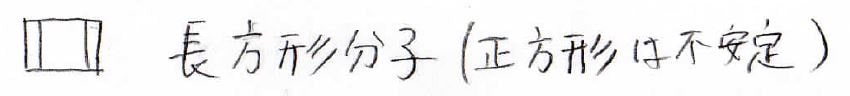
また、芳香族と反芳香族のいずれにも属さないものは、非芳香族と呼ばれます。
非芳香族には、そもそも環状ポリエンでないものや平面構造自体が不安定なものが含まれます。
その例がブタジエンや、シクロオクタテトラエンです。
シクロペンタジエンのように\(\displaystyle \rm{sp}\)\(^3\)混成軌道をもつ炭素原子がある場合もこの非芳香族です。

反と非は英語で表すとantiとnonです。
反芳香族は共鳴で不安定化するもの、非芳香族はそもそも物理的に芳香族になりえないものですので、混同しないように区別して理解しておきましょう。
ヒュッケル則がなぜ成り立つのかは、量子力学によって説明されます。
詳しくは、こちらの記事で解説しています。


練習問題
最後に、練習問題をやって終わります。
1. カルボン酸が酸である理由を説明してください。
2. メチルベンゼンとエチルベンゼンの末端水素を比べて、酸性度が高い方はどちらかを理由も含めて考えてください。
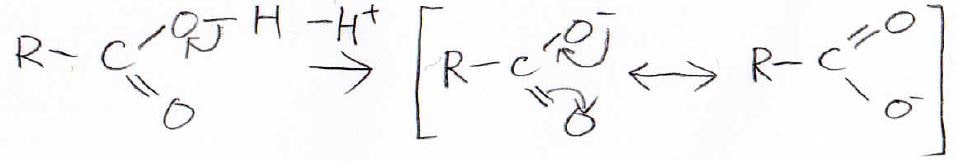
負電荷が上側の酸素に位置した構造と下側の酸素に位置した構造で、共鳴構造を書くことができます。
これにより共鳴安定化するため、プロトンが外れやすくなります。
すなわち、酸としてはたらくことになります。
2. 先ほどと同じように、仮にプロトンが外れたときにできるアニオン種の共鳴構造を考えていきましょう。
まず、メチルベンゼンの場合、このように5個の共鳴構造を書くことができます。
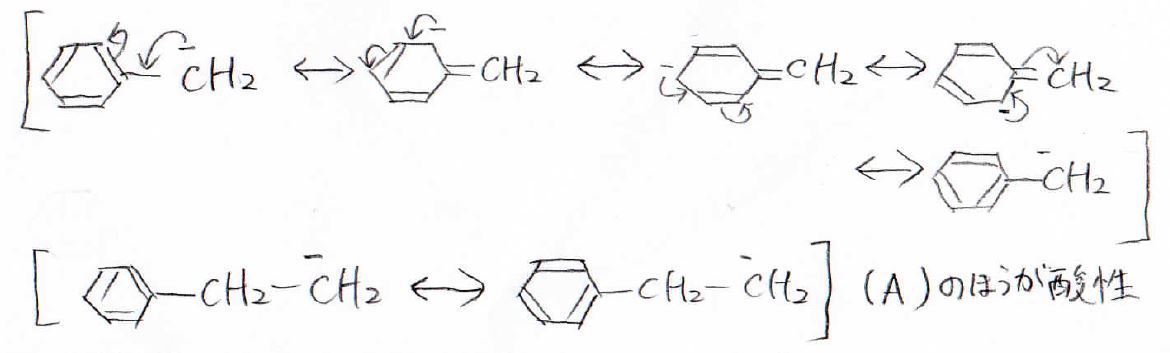
しかし、エチルベンゼンの末端水素がプロトンとして脱離した場合は、2つの構造しか書くことができず、負電荷は末端に局在化しているので、メチルベンゼンの場合に比べて共鳴安定化の効果は小さいと考えられます。
したがって、メチルベンゼンの末端にある水素のほうが酸性度が大きくなります。
ベンゼンの隣の炭素はベンジル位と呼ぶのですが、このように共鳴安定化の効果を受けるので、非常に反応性に富む位置となります。
エチルベンゼンに塩基を加えた場合は、ベンジル位の水素がもっとも優先的に引き抜かれることになります。
まとめ
はい、今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!