こんにちは!
それでは今回も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(symmetry)
それでは内容に入っていきます!
より安定な分子とは
今回は、第2周期元素の等核二原子分子を例にお話ししていきます。
これまでやってきた共有結合の考え方を使うと、このようなポテンシャル図を書くことができます。
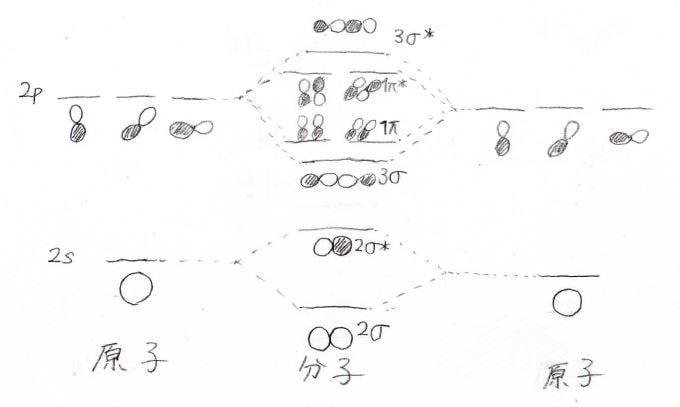
共有結合についてはこちらの記事をご覧ください。
では、実際の分子もこのポテンシャルのような分子軌道をもつのかというと、実は違います。
さらに安定な状態が存在します。
それを考えるのに重要なのは、軌道の対称性です。
対称性が同じ軌道どうしは、相互作用することができて、より安定な軌道とより不安定な軌道を作ることができます。
等核二原子分子の対称性は、分子の重心から見て対称(ゲラーデ, gerade)か反対称(ウンゲラーデ, ungerade)かという2通りのことを指します。
\(\displaystyle \sigma\)結合の結合性軌道と\(\displaystyle \pi\)結合の反結合性軌道はgerade、\(\displaystyle \sigma\)結合の反結合性軌道と\(\displaystyle \pi\)結合の結合性軌道がungeradeになります。

相互作用はgeradeの軌道どうし、ungeradeの軌道どうしで起こり、安定な軌道はより安定に、不安定な軌道はより不安定になります。
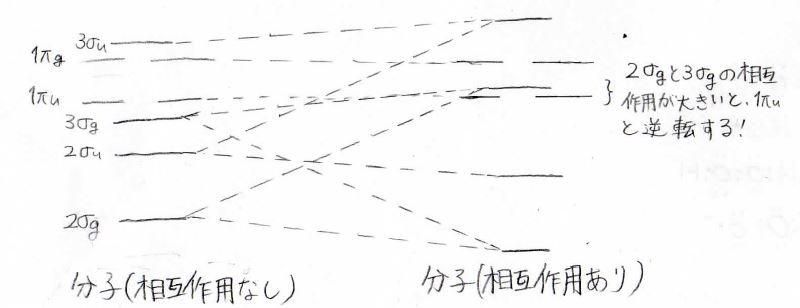
ここで最も重要なことは、エネルギーの逆転が起こりうるということです。
\(\displaystyle 2\sigma_\rm{g}\)と\(\displaystyle 3\sigma_\rm{g}\)の相互作用が大きいときには、\(\displaystyle 1\pi_\rm{u}\)と\(\displaystyle 3\sigma_\rm{g}\)の逆転が起こります。
軌道間の相互作用の大きさは、2つの軌道の重なり度合いに影響されます。
第2周期では原子番号が大きくなるほど、静電反発を避けるために大きく電子が広がります。
すると、相互作用が小さくなるため、逆転は起こりません。
逆に言えば、原子番号が小さいほど、この逆転が起こりやすいことになります。
\(\displaystyle \rm{Li_2}\)から\(\displaystyle \rm{F_2}\)までの分子軌道
それでは実際に、これらの分子軌道を見てみましょう。

軌道の逆転が起こらなくなるのは、\(\displaystyle \rm{N_2}\)と\(\displaystyle \rm{O_2}\)の間になります。
そして、この中で\(\displaystyle \rm{Be_2}\)だけは存在しません。
結合性軌道の電子数と反結合性軌道の電子数の差を\(\displaystyle 2\)で割った値は結合次数と呼ばれ、これが\(\displaystyle 0\)になったときには、その分子は存在しないということになります。
\(\displaystyle 0\)になるということは結合性軌道と反結合性軌道に同じ数の電子があるということなので、分子を形成したことによる安定化が起こりません。
自由エネルギーで考えると、結合ができたことによって原子の並進運動が制限されて、むしろエントロピーは減少します。
エンタルピーが負でない限り、原子のままでいたほうが熱力学的には有利となります。
\(\displaystyle \rm{B_2}\)と\(\displaystyle \rm{O_2}\)の磁性
そして、上記の分子軌道を見ていて、もう1つ気付くことがあります。
それは、\(\displaystyle \rm{B_2}\)と\(\displaystyle \rm{O_2}\)だけ最外殻に不対電子を2つもつ電子配置が最安定になるということです。
フントの規則より、これらは同じ方向のスピンをもつわけですが、これにより分子全体が磁気モーメントをもつことになります。

これにより、\(\displaystyle \rm{Fe}\)や\(\displaystyle \rm{Ni}\)、\(\displaystyle \rm{Co}\)などと同様に、磁場をかけると分子の磁気モーメントも方向がそろう常磁性という性質をもつようになります。
気体の場合は運動が激しいため、大気中で磁石をおいても磁石の周りに酸素の層ができることは考えにくいですが、運動性を下げて液体酸素にした場合には、実際に磁石に引き寄せられていく酸素の姿を確認することができます。
液体酸素は少し青みがかっていて、液体窒素を使えば簡単に作ることができます(酸素は助燃性があって危険なため、実験室ではむしろ作らないように留意するのが普通です)。
\(\displaystyle \rm{B_2}\)、\(\displaystyle \rm{O_2}\)以外の\(\displaystyle \rm{Li_2}\)、\(\displaystyle \rm{C_2}\)、\(\displaystyle \rm{N_2}\)、\(\displaystyle \rm{F_2}\)は磁石には付かず、反磁性と言われます。
もし分子軌道のエネルギー逆転がなかった場合には、この磁性は変わっていました。
酸素分子の活性
対称性と相互作用の話は以上なのですが、最後にコラムとして酸素分子の話をします。
化学の世界で、不対電子をもっている化学種はラジカルと言って、その中でも不対電子が2つあるものはビラジカルと呼ばれます。
酸素原子はビラジカルの状態が基底状態となるわけですが、一般的にラジカルは反応性が高くて、多様な反応を起こしやすいです。
(安定なラジカルも一部存在していて、試薬として売られているものもあります。ラジカル周りに嵩高い置換基を付ける、共鳴効果を利用するなどの方法で反応性を下げています。)
生体内では数多くの化学反応が、実験室よりもはるかに高い精度で行われているので、ラジカルはそれを阻害する悪者になります。
しかし、我々も含む多くの動物は、酸素がないと生きていくことができません。
なぜこうなったのかというのは、地球の歴史を考えるとわかります。
今から約30億年前、地球上にシアノバクテリア(藍藻)という生物が誕生しました。
当時、猛毒である酸素を生きていくために使うということはありえないため、生物たちは酸素ではない他の気体を介して呼吸してきたのですが、シアノバクテリアは酸素を発生させる光合成(酸素発生型光合成)を行う生物でした。
事件が起こったのは今から27億年前、シアノバクテリアが繁殖し、大気中に酸素が含まれるようになりました。
当時の多くの生物は嫌気呼吸(酸素以外での呼吸)をする生物で、酸素は毒でしたなかったため、大量に絶滅することになりました。
そこで生き残ったのが好気呼吸(酸素で呼吸)をする生物たちです。
これらは酸素の高い反応性を逆に利用して、エネルギー通貨であるATPの合成や、老廃物の分解を行うことで、酸素を消費することができました。
しばしば活性酸素という言葉を耳にしますが、これらは好気呼吸の生物にとって悪者とは限らず、がん細胞の処理という重要な役割も担っています。
ちなみに活性酸素というのは総称で、一重項酸素、ヒドロキシラジカル、過酸化水素、スーパーオキシドをまとめてそう呼んでいます。

ここで出た一重項酸素というのは、フントの規則に従わない不安定な酸素分子のことです。

基底状態は右側の三重項酸素で、大気中に存在する酸素分子の多くがこちらの状態にあります。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!




