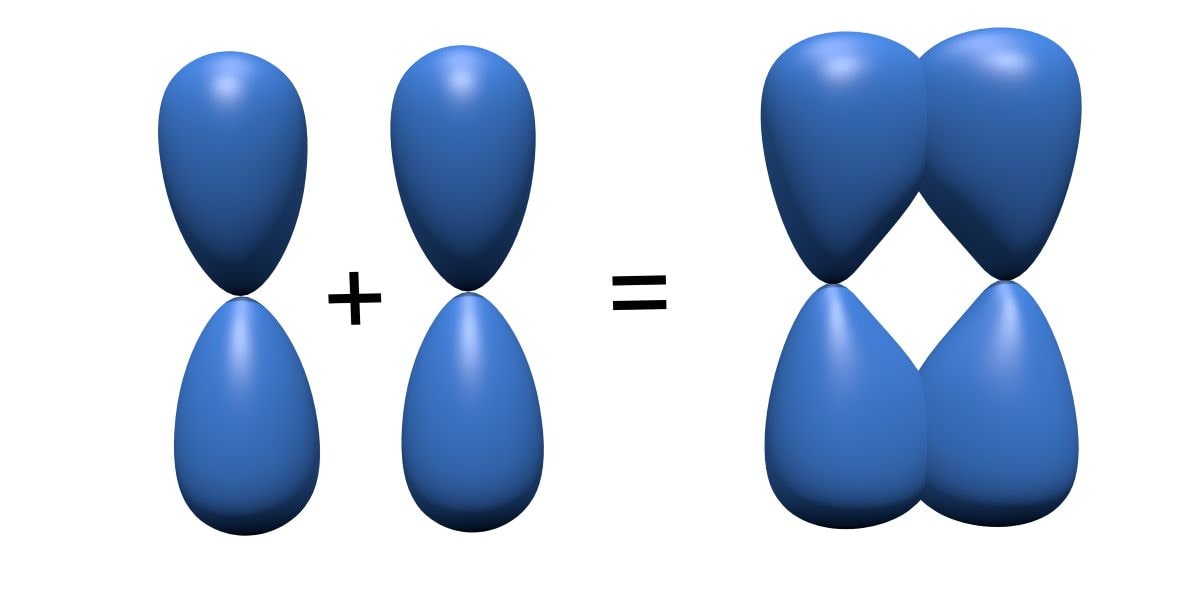こんにちは!
それでは今回も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(covalent bond)
なぜ電子を共有すると結合ができるのかということは共鳴積分というもので説明してきましたが、今回はもっと詳しく見ていこうと思います。
共鳴積分については水素分子イオンと水素分子についてお話しした記事をご覧ください。

それでは、内容に入っていきます。
結合性軌道と反結合性軌道
まず、始めに共有結合とはというところから行きますと、これは2つ以上の原子核が電子を共有することで形成される結合のことです。
高校でもそれは習いますが、なぜ電子を共有すると結合ができるのかという説明はされなかったと思います。
この動画では量子力学の観点から詳しく見ていきます。
1個の電子が2つの核に拘束されると、原子の時のエネルギーを基準に2つの効果が現れます。
その効果がクーロン積分と共鳴積分です。
詳しくは水素分子イオンの記事でお話ししてますが、簡単におさらいしておくと、クーロン積分は新たに原子核が増えたことで電子との間に働く静電引力を反映しています。
これに対して共鳴積分では静電相互作用は関係なく、量子が交換されることで安定化するという、量子力学特有の効果であると言えます。
そしてこの効果を考えた結果、このようなグラフが得られます。
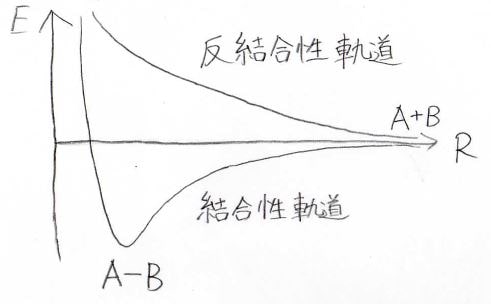
横軸が核間距離、縦軸が結合ができる前の値を基準としたエネルギーです。
エネルギーを求める過程でニ次方程式が出てくるので、答えは2つ出てきます。
これらの状態には名前がついていて、単調減少している方を反結合性軌道、もう一方の非調和な振動ポテンシャルとなる方を結合性軌道といいます。
では、順番に説明していきます。
結合性軌道
まずは結合性軌道からです。
これは共有結合ができたことによる安定化がどれくらいかと言うのを表します。
ポテンシャルの極小が小さいほど、その結合は安定だと言えます。
また、一般的にはエネルギーが極小となる平衡核間距離が小さいほど安定な結合となります。
水素分子を例にすると、このように\(1\rm{s}\)\(\)軌道同士が同じ位相となって重なることでこの状態となります。

この結合様式は対称であり、対称を指すドイツ語でgerade(ゲラーデ)というので、知っておいてください。
反結合性軌道
続いて反結合性軌道です。
定常状態であれば電子はこっちの軌道にはいないので、こっちを考える必要があるのかと思う方もいるかもしれませんが、こっちは結合の解離を理解する上でとても重要になります。
熱や光によってエネルギーを受け取った電子は結合性軌道から反結合性軌道に移ります。
ですが、反結合性軌道はエネルギーが高く不安定です。
このポテンシャルカーブは核間距離に対して単調減少するため、より安定な状態になるためには核間距離が大きくなっていく必要があり、再び結合性軌道に戻らずにこれが起こってしまうと結合が切れてしまいます。
このように反結合性軌道はエネルギーの吸収、分解、反応機構の理解などに必要な概念だと言うことになります。
水素分子を例にするとこのように2つの\(1\rm{s}\)軌道が逆位相で近づいたような状態となっていまして、2つの核の中心には波動関数の位相が反転する節があります。

この節では電子の存在確率は\(0\)になりますので、中心には電子は無いということになります。
一般的に節の数が多いほど不安定になりますので、ぜひ知っておいてください。
同核、異核での共有結合におけるポテンシャルの違い
それで、平衡核間距離におけるポテンシャル図は同じ元素間と、違う元素間では少し形が変わるので、それもお話ししておきます。
同核の場合はこのように結合性軌道の安定化と反結合性軌道の不安定化はほとんど同じくらいになります。
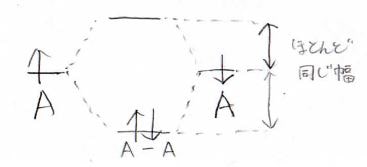
厳密には同じではありませんが、だいたい同じと思っておけばいいと思います。
異核の場合は、そもそも結合を作る前の状態でエネルギーに差がありますが、結合性軌道は2つの原子のうちエネルギーが低い方に近いエネルギーになります。
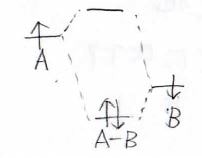
反結合性軌道は反対に高い方のエネルギーに近くなります。
エネルギーが近いということは構造が似ているという風に考えるのが自然なので、この場合であれば、電子が少し\(\rm{B}\)\(\)の原子核に偏っているような構造が安定だということが考えられます。
電気陰性度という言葉を使うとイメージしやすいと思います。
共有結合の種類
はい、では続いて共有結合の種類を見ていこうと思います。
どういう分類をするかというと、ずばり節の本数です。
ひいてはその共有結合によってどれくらい安定化が起こるのか、すなわち結合の強さの違いです。
\(\sigma\)結合
もっとも強い共有結合は\(\sigma\)(シグマ)結合といいます。
ここからは結合を作る2原子は\(x\)軸上にあるとしてお話しします。
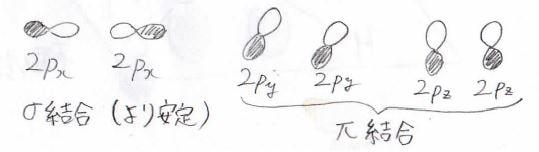
\(\sigma\)結合の例は\(\rm{s}\)\(\)軌道同士、\(\rm{s}\)\(\)軌道と\(\rm{p}\)\(_x\)軌道、\(\rm{p}\)\(_x\)軌道同士などで形成される共有結合です。
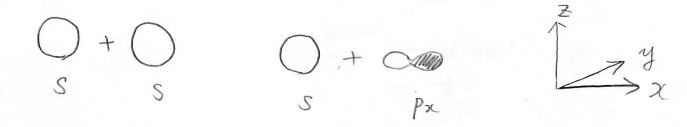
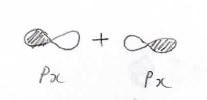
これらを\(x\)軸方向から見た時には節はなく、これが最も安定化の効果が大きいということになります。
\(\pi\)結合
続いての共有結合が\(\pi\)(パイ)結合です。
これは\(\rm{p}\)\(_y\)軌道同士、\(\rm{p}\)\(_z\)軌道同士、\(\rm{d}\)\(_{zx}\)軌道と\(\rm{p}\)\(_z\)軌道などの組み合わせでできる結合です。

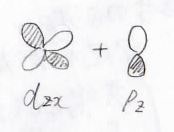
いずれも\(x\)軸方向から見た時に\(y\)軸と\(z\)軸のいずれかが節となる形をしており、\(\sigma\)結合よりは弱い結合になります。
\(\delta\)結合
そして、節が2本となるのが最後に紹介する\(\delta\)(デルタ)結合です。
これは\(\rm{d}\)\(_{yz}\)軌道同士などで形成される結合を指します。
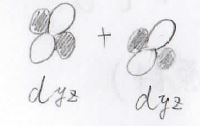
\(\sigma\)結合、\(\pi\)結合に比べると弱い結合になります。
実際にある分子を考えてみよう!
では最後にここまでやってきたことを踏まえて、実際にある分子にどういうことが言えるだろうかということを考えていきます。
窒素分子の三重結合
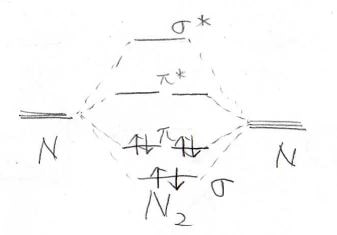
まず始めに窒素分子の三重結合を考えてみましょう。
窒素原子の電子構造はこのように3つの\(2\rm{p}\)\(\)軌道に1つずつ電子が入っていて、希ガス構造となるためには、これら3つの電子を出し合って共有結合を作ることになります。

その時に仮に\(\rm{p}\)\(_x\)同士で\(\sigma\)結合を作るとなると、\(\rm{p}\)\(_y\)と\(\rm{p}\)\(_z\)は平行な形で結合を作るしかなくなります。
その結果、三重結合のうち1本は\(\sigma\)結合、2本は\(\pi\)結合だということになります。
そしてポテンシャル図はこのようになります。
\(\sigma^\ast\)、\(\pi^\ast\)はそれぞれの反結合性軌道を指しています。
アミド結合(ペプチド結合)
続いて考えるのはアミド結合です。
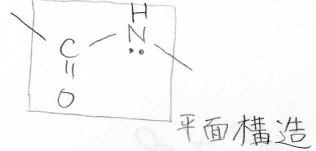
アミノ酸同士で形成されるアミド結合はペプチド結合とも呼びます。
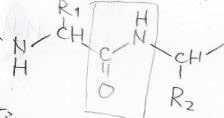
この結合は\(\rm{C-N}\)\(\)単結合よりも強いことが知られており、ナイロンやたんぱく質の力学的な強度や安定性を支えています。
そして、この結合において\(\rm{C}\)\(\), \(\rm{O}\)\(\), \(\rm{N}\)\(\), \(\rm{H}\)\(\)は同一平面上にあることが知られています。
なぜそうなるかと言えば、それが安定だからということになるのですが、なぜ安定なのかを考える際には\(\pi\)結合の知識が役に立ちます。
この平面を横から見るとこんな感じになってまして、平面から垂直な方向に\(\rm{p}\)\(\)軌道があります。
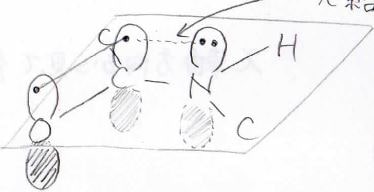
カルボニルの\(\rm{C}\)\(\)と\(\rm{O}\)\(\)は互いの\(\rm{p}\)\(\)軌道の電子を分け合って、\(\pi\)結合を形成していますが、その近くに窒素原子の孤立電子対がこれもまた垂直な方向に出ています。
量子力学において直交性というのがありますが、垂直ではない軌道同士は相互作用する可能性があります。
ここでは平行となっている軌道同士で電子の非局在化が起こり、さらなる安定化が起こります。
過去にお話ししました、共鳴として考えても同じですが、このように疑似的な\(\pi\)結合による安定化が起こることがありますので、ぜひ知っておいてください。
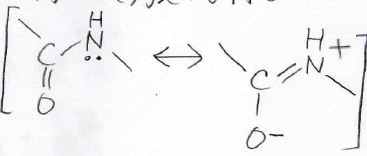
共鳴についてはこちらの記事をご覧ください。
ブタジエン
同じことはブタジエンにも言えます。
これは合成ゴムの原料としてよく知られている物質です。
ブタジエンの構造はこのようになっており、二重結合が2つあって、真ん中の結合だけが単結合となっている、そんな構造をしています。
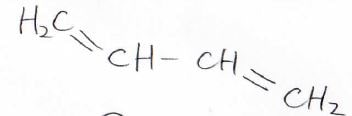
しかし実はこの真ん中の単結合は、普通の\(\rm{C}\)\(-\rm{C}\)\(\)結合よりも強い結合であることが知られています。
これの理由は先ほどと同じで、全ての炭素原子が同一平面上に位置して\(\rm{p}\)\(\)軌道同士で2つの\(\pi\)結合を作っています。
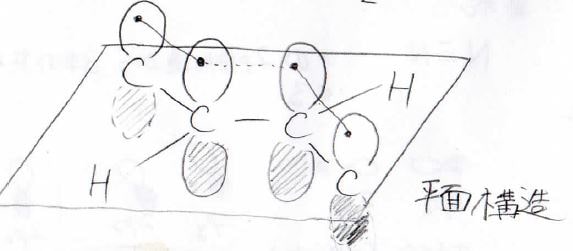
この際、2番目と3番目の炭素原子についても平行な軌道同士で\(\pi\)結合のような相互作用が起こるため、普通の単結合より安定な結合となります。
これらのように平面に垂直な\(\rm{p}\)\(\)軌道間では、まるで\(\pi\)結合のような安定化が起こって一般的な単結合よりも強い結合となることがあります。
構造式で見れば単結合でも実態は異なるということがありますので、平面になっていることをイメージすることが、その安定性を理解するためには必要になってくるということです。
まとめ
はい、それでは今回の内容は以上ですので、最後軽くおさらいをやって終わります。
今回は共有結合の基本をお話ししました。
2つの原子から共有結合ができた時、2つの軌道ができます。
結合性軌道は結合ができることによる安定化、反結合性軌道は結合の解離を理解するために重要なものになります。
結合を作る原子核が同じ元素である場合には結合性軌道の安定化と反結合性軌道の不安定化の効果はほとんど同じとなります。
異なる元素同士の共有結合では結合性軌道はより低いエネルギーの原子と近いエネルギー、反結合性軌道はより高いエネルギーの原子と近いエネルギーを持ちます。
エネルギーが近い値であることは似た構造をしているという風に考えることができるので結合性軌道ではより安定な原子側に電子が分極しているということになります。
このことは電気陰性度という言葉でも理解できると思います。
そして次に共有結合の種類についてもお話ししました。
\(\sigma\)結合、\(\pi\)結合、\(\delta\)結合の順に結合が弱くなっていきます。
これは節の本数の違いでも理解することができますので知っておいてください。
そして最後には実際にある分子を例にお話ししました。
まず、窒素分子の三重結合を考えました。
\(\rm{p}\)\(_x\)軌道同士で\(\sigma\)結合を作ると\(\rm{p}\)\(_y\)と\(\rm{p}\)\(_z\)は\(\pi\)結合を作ることになります。
そのため、三重結合とは言っても一本ごとの結合の強さは同じではなく、1本だけが\(\sigma\)結合で強く、2本は\(\pi\)結合、つまり\(\sigma\)結合より弱い結合になります。
そしてほかの例にはアミド結合とブタジエンの話をしました。
どちらも平面構造を有しており、その平面に垂直な\(\rm{p}\)\(\)軌道同士で\(\pi\)結合のような安定化を考えることができ、実際に構造式通りの単結合よりも強い結合となります。
これは共鳴、すなわち電子の非局在化としても理解することができます。
それではどうもありがとうございました!