こんにちは!
それでは今回も化学のお話やっていきます。今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(¹³C-NMR)
それでは内容に入っていきます!
¹³C-NMRを測定する意義
まず始めになぜ¹H-NMRだけでなく¹³C-NMRを測定するのかということからお話ししていきます。
結論を先に言いますと、¹³C-NMRのメリットは¹H-NMRの複雑さを回避できることにあります。
¹H-NMRではスピン-スピン分裂が顕著に現れるため、こんな風に非等価な隣接水素が何種類もあると、何本に分かれているのかもよくわからないような多重線が得られることがあります。


こうなるともはや人の手では解析できず、コンピュータに頼らざるを得ない状態になります。
¹³C-NMRではこの複雑さが消える、もしくは消すことができるというのです。
ではなぜ¹³C-NMRだとそうなるのか?その理由を見ていきましょう。
NMR活性な核種の天然存在比
なぜ炭素原子を使うのか
有機化合物に含まれる元素の種類は少なく、炭素、水素のほか酸素や窒素、ハロゲンなどがあります。

この中でCとH以外の元素はヘテロ原子と呼ばれ、この原子の周りは反応性が高くなるなどその化合物の物性を大きく決めてしまう要素になります。
そしてその化合物によってはあったりなかったりするイレギュラーな元素です。
これらに対し、CとHは分子の骨格を作る基本要素であり、ほとんどの有機化合物に含まれています。
そのため、炭素か水素のNMRをすれば、未知の構造を同定できる可能性が高いということになります。
NMR活性と天然存在比
そこで次にNMR活性、すなわち0ではない核スピンをもつ同位体はどれかなというのを考えます。
水素の場合は質量数1の水素原子、炭素の場合は質量数13の炭素原子になります。
ここで注目すべきはそれぞれの天然存在比です。
水素の場合実に99%以上の原子が質量数1であるのに対し、炭素の場合はほとんどが質量数12であり、13の炭素原子は約1.1%しか存在していません。
天然存在比が低いということは同一の分子内でカップリングするほど近くに位置する可能性がとても低いということになるので、炭素原子同士のカップリングは起こらないと考えることができ、1H-NMRに比べてスペクトルが単純化しやすいということになります。
¹³C-NMRと¹H-NMRの違い
ではここで¹³C-NMRと¹H-NMRの違いを2つ見ていきます。
ピーク強度
1つ目はピークの強度が大きく異なるということです。
¹³Cは天然にちょっとしか存在していないので、ピークが見にくいというのはイメージしやすいかと思います。
ちなみに¹H-NMRにおいてH-¹³Cカップリングが見えないのはこの天然存在比が理由です。
ただ、原子1個当たりの共鳴強度で比べたとしても¹Hの方がピークが大きくなるため、そのダブルパンチで¹³C-NMRのピークは小さくなります。
仮に同じ測定条件で両方のピークを取ったとすると、¹³Cのピークは¹Hの約6000分の1になるそうです。
これを精度よく測定するためには、長時間測定するというのもいいんですが、もっと現実的な方法があります。
それがフーリエ変換を使って数学的に解析するということです。
FTというのがFourier Transform、すなわちフーリエ変換を指すんですが、得られる信号をいくつかの周波数のラジオ波パルスを足し合わせたものと考えることで、短時間の測定でも大きなピークが得られることになります。
この測定原理については過去に挙げたNMRの原理という記事でもお話ししているので、もしよければそちらも見てください。

化学シフトの領域
そして2つ目の違いがスペクトルが現れる化学シフトの領域です。
¹Hの場合、10 ppmくらいまででほとんどのピークをとらえることができますが、¹³Cの場合は約200 ppmまで行くことがあり、広い範囲にわたるラジオ波の吸収が起こっています。
¹³C-¹Hカップリング
では今度、¹³C-¹Hでのカップリングというものを紹介します。
ここまで¹³C-NMRは単純なスペクトルを得られますよと言ってきたんですが、考えてみれは¹³Cの近くに¹³Cはなくても¹Hがあることがほとんどです。
実際、これらは大きなカップリング定数を持つため、例えばブロモエタンの¹³C-NMRはこのようになります。
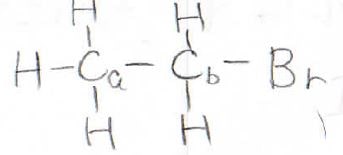
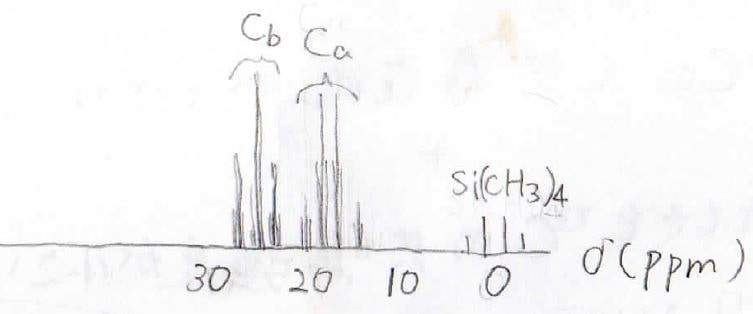
そのカップリング定数は125~200 Hzにまで上ります。
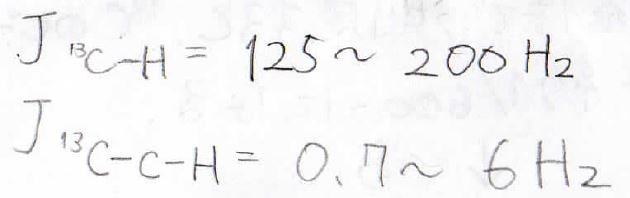
隣接している炭素原子に結合している¹Hとのカップリング定数は0.7~6 Hzでして、一気に小さくなります。
でもこのままだと、せっかく単純なスペクトルを得るために¹³C-NMRを測定したのに、カップリングがバンバン起こっちゃっていて、そのメリットがありません。
じゃあ、結局意味ないのかというと、そうではありません。
実は¹³C-¹Hカップリングは広帯域水素デカップリング、もしくはプロトンデカップリングという手法で取り除くことができます。
その方法はこんなイメージです。
例えば↓の物質に対して外部磁場7.05 Tで低分解能のNMRの測定をしたときには炭素原子が73 Hz、水素原子が300 Hzの電磁波を吸収します。

ここで両方の電磁波を同時に照射すると、炭素と水素が同時に共鳴することになります。
そしてスピン状態がαからβへ交換する速さは炭素よりも水素の方がとても速いため、炭素から見た時には水素の動きが追えなくなります。
こうなるとNMRの共鳴ピークははっきりと分かれなくなり、デカップリングします。
結果、水素と結合している炭素のピークでも単一線として現れることになります。
ブロモエタンのスペクトルはこうなります。
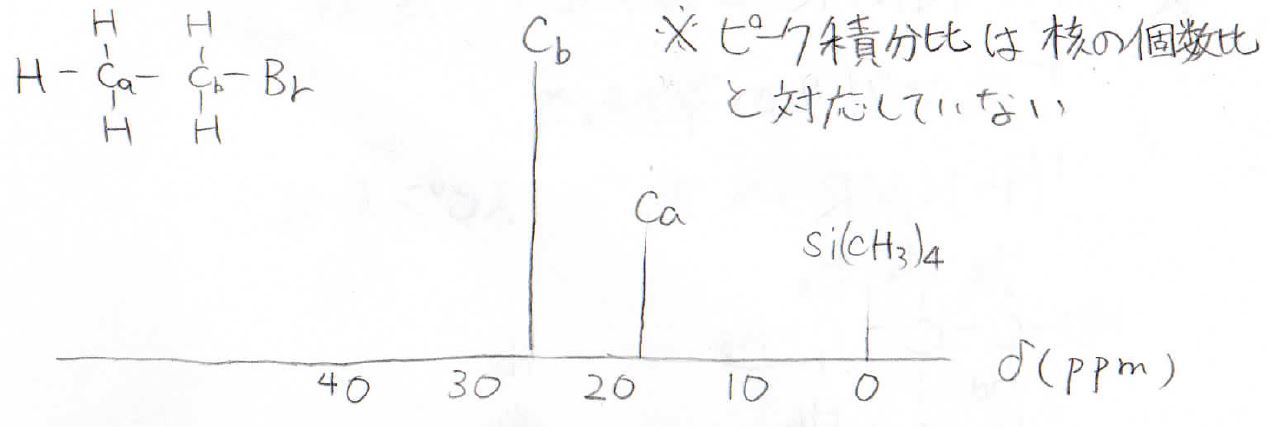
ここで、注意してもらいたい点が一点ありまして、¹H-NMRではピークの積分比がそのまま個数比でしたが、プロトンデカップリングさせた¹³C-NMRではこんな風に個数比と対応しません。
ぜひ知っておいてください。
代表的な構造に対応する化学シフト値
そしてこの単純なスペクトルを使って化合物の同定ができます。
ここに示すのは代表的な構造の化学シフトです。
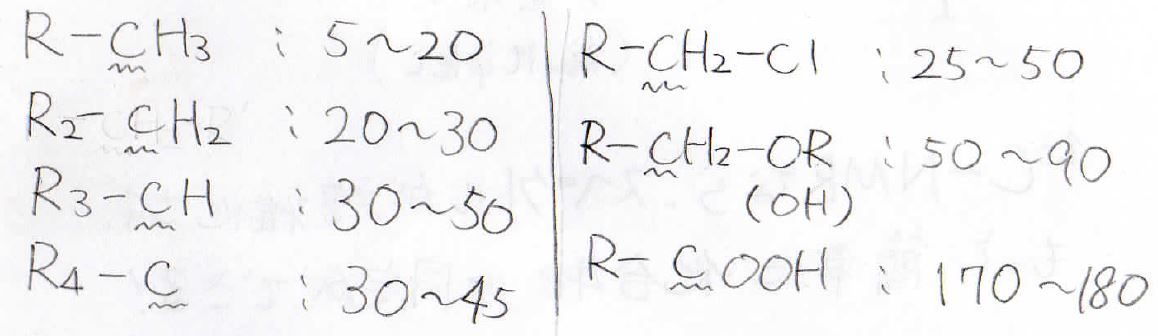
有機化学の教科書なら必ず載っているはずなので、このほかの構造についてはお持ちの教科書をめくってみてください。
異性体を持つ化合物の同定
そしてこれが最後の話題になります。
¹³C-NMRでは等価な炭素原子の種類の数だけピークが現れるため、異性体が存在する化合物の同定に特に真価を発揮します。
例えば、元素分析、質量分析にて未知物質の分子式がC7H14と分かっているとします。
しかし、C7H14にはこのようなシクロアルカンの異性体があります。
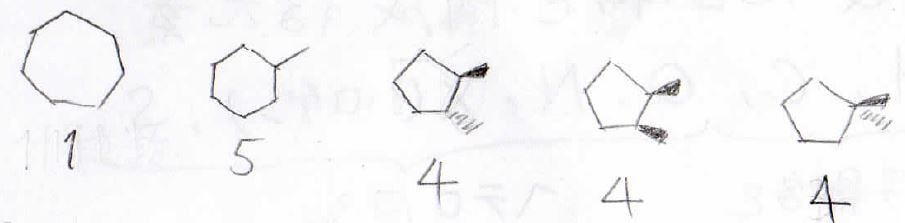
このほかにもありますし、何ならアルケンかもしれません。
こんな時に注目してほしいのが等価な炭素原子の個数です。
構造の下に示した数字は等価な炭素原子の数を表しています。
この数字と¹³C-NMRのピークの本数が異なる場合はその構造の可能性を否定することができます。
練習問題
ということで、最後は練習問題を用意しました。
分子量が70の炭化水素、すなわち構成する元素が炭素と水素のみである化合物で¹³C-NMRのピークが4本ありました。
考えられる構造を全て答えてくださいというのが問題です。
分子量70の炭化水素ということで考えられる分子式はC5H10になります。
不飽和度は1であり、シクロアルカンかアルケンだと考えられます。
あとは考えられる異性体の中から化学的に等価な水素原子が4個のものを探してあげると、メチルシクロブタンと3-メチル-1-ブテンが該当します。
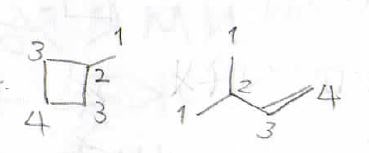
あとは付加反応が起こるか調べてあげれば、どちらの化合物か断定することができます。
こんな感じで、¹³C-NMRでは化学シフトの値を無視してピークの本数だけでも化合物が分かってしまうことがありますので、知っておいてください。
まとめ
はい、それでは今回の内容は以上です。
最後に軽くおさらいをやります。
今回は¹³C-NMRについてお話ししました。
質量数12の炭素原子は核スピンがないため、質量数13、天然に約1%しか存在しない方を使うというのが重要なポイントでして、これにより炭素同士のカップリングを考えなくてよくなります。
炭素と水素のカップリングはそれぞれの共鳴周波数の電磁波を同時照射することで回避することができ、きれいな単一線しかないスペクトルを得ることができます。
ピークの本数は化学的に等価な炭素原子の種類の数を表すため、異性体が存在する分子の同定にはとても強力なツールとなります。
それではどうもありがとうございました!