こんにちは!
それでは今回も化学のお話やっていきます。今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(hybrid orbital)
それでは内容に入っていきます!
混成軌道って何?
まず混成軌道とは何かというところからお話ししますね。
混成軌道とは原子が結合を作るときに、最終的に一番大きな安定化が得られるように、元からある原子軌道を組み合わせてできる新しい軌道のことを言います。
とは言っても、実際に軌道が組み合わされる現象が見えるのかというと、それは微妙なところでして、原子の価数、立体構造を理解するうえでとても便利な考え方だから、受け入れられているものだと考えてください。
ここで何を言ってるのかわからない方も大丈夫、分かれば超簡単なので順番に見ていきましょう!
まずこの混成軌道の考え方は価数、つまり原子から伸びる腕の本数を説明するのに役立ちますので、ここから始めたいと思います。
知っての通り炭素原子の腕の本数は4本です。
しかし、炭素原子の電子構造を考えてみるとちょっと不思議なことが見えてきます。
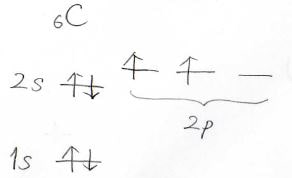
共有結合を作るためには1個ずつ電子を出し合わないといけないため、電子が1個だけ占有している軌道でないと共有結合を作ることはできないはずです。
そして炭素原子の電子軌道をもう一度見てみますと、そんな軌道は2つしかありません。
すなわちこのままでは2本までの結合しか説明できないことになります。
じゃあ、どうやって4本の結合ができるのだろうかという疑問にもっともらしい解釈を与えてくれるものこそがこの混成軌道だというわけです。
それではここから、混成軌道の例を実際に見ていきましょう!
混成軌道の例
もう一度繰り返しになりますが、混成軌道とは原子軌道を組み合わせてできる軌道のことですから、どういう風に組み合わせるのかということに注目しながら、読み進めてください。
よく出てくる、軌道を組み合わせるパターンは全部で3つあります。
それぞれは何方向に結合を作るのかという違いだと、ひとまずは考えてください。
sp³混成軌道
例えばまず、4方向に結合を作る場合を見てみましょう。
混成軌道を考えるとき、始めにすることは昇位です。

2s軌道の電子を1つ、空の2p軌道に移して主量子数2の計4つの軌道に電子が1つずつ入るようにします。
一般的に2s軌道は2p軌道よりも少しエネルギーが小さいため、昇位はエネルギー的に不利な現象なのですが、ここでは最終的に結合を作った時に最安定となることを目指しています。
そのため、終わりよければ総て良し的な感じで、昇位してもよいだろうと考えます。
そして1つのs軌道と3つのp軌道を混合して、エネルギー的に等価な4つの軌道ができたと考えます。

これが混成です。
こうやってできた軌道は、1つのs軌道と3つのp軌道からできているという意味でsp3混成軌道と呼びます。
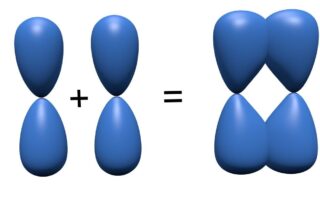
個々の軌道の形は位相の強め合いと打ち消しあいで、このようになります。

これらが空間中に配置されるときには電子間で生じる静電反発が最も小さい形をとろうとします。
4方向に伸びる場合にはこのように四面体型が最も安定な構造になります。

2つのsp3軌道がなす角は約109.5°になります。
sp²混成軌道
3方向に結合を作る場合には、先ほどと同様に昇位した後に1つのs軌道と2つのp軌道で混成が起こり3つのsp2混成軌道ができます。


p軌道のうち1つだけはそのままになります。
これらが静電反発を避けるためにはまず、等価な3つのsp2軌道が正三角形を作るように結合角約120°で3方向に伸びます。
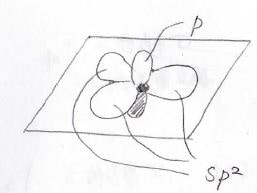
その後、残ったp軌道が3つのsp2軌道との反発を避けるためにそれらがなす平面と垂直な方向を向いて位置することになります。
sp混成軌道
2方向に結合を作る場合には、昇位の後、s軌道とp軌道が1つずつ混ざり合って2つのsp混成軌道ができます。


2つのp軌道はそのまま残ります。
空間上に配置するときにはまず等価な2つのsp軌道が反発を避けるため、同一直線上の逆方向に伸びていきます。
残った2つのp軌道はその直線に垂直な方向に来ます。

また、p軌道同士でも垂直になるはずなので、このような配置になります。
化合物の立体構造
ではここからは、この混成軌道のルールを使って化合物の立体構造を予想してみましょう。
どの混成軌道か見分けるための重要なポイントは、注目している原子の周りでσ結合と孤立電子対が合わせていくつあるかということです。
結合についてはこちらの記事で詳しく解説しています。
先ほどは分かりやすさのために、結合が何方向に伸びているかということで説明しましたが、より正確には何方向に電子対が向くのかということを考える必要があります。
アンモニア
それではまずアンモニアを例に立体構造を考えてみましょう。
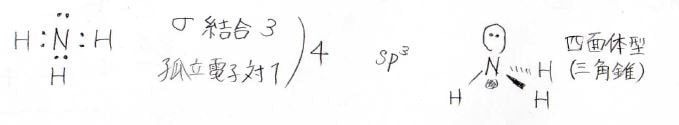
アンモニアの窒素原子に着目するとσ結合が3本、孤立電子対数が1になっています。
混成軌道を考える際にはこれらの合計数が重要になります。
この場合は4なので、sp3混成になり、四面体型に電子が配置します。
窒素原子と水素原子のみに着目した場合には高さが低い四面体型、三角錐になります。
孤立電子対があるので、絶対に正四面体型の分子とは言えません。
そこだけ注意しましょう。
水
続いて水の場合も考えてみましょう。

酸素原子についてσ結合が2本と孤立電子対が2つあります。
これらの和は4であるため、これもsp3混成になります。
水素原子と炭素原子のみに着目すると折れ線型の分子になりますが、孤立電子対も考えるとこのような四面体型になります。
ただし、実際の水分子の結合角は104.5°であり、正四面体型で想定される109.5°とは乖離があります。
これは、孤立電子対間の静電反発が共有電子対のものよりも大きいのが理由です。
エチレン
では次にエチレンの炭素原子について考えてみましょう。

σ結合は3本、孤立電子対は0で、その和は3になります。
この時にはsp2混成となり、平面構造になります。
この平面に垂直な方向にp軌道があり、隣接している炭素原子との間でπ結合を作っています。
二酸化炭素
では最後、二酸化炭素の炭素原子について考えてみましょう。
σ結合は2本、孤立電対は0です。
その和は2となるためsp混成となり、このような直線型の構造を取ります。
このようにσ結合の数と孤立電子対数の和を考えればその原子の周りの立体構造を予想することができます。
この考え方の例外
ただし、この考え方は万能ではなく、平面構造を取ることで共鳴安定化が起こる場合には通用しないことがあります。
その例はアミド結合の窒素原子です。

σ結合が3本で孤立電子対が1つあり、その和が4なのでsp3混成だと考えてしまいがちですが、このように電子が非局在化した方が安定なため、そのためにsp2混成の平面構造を取ります。
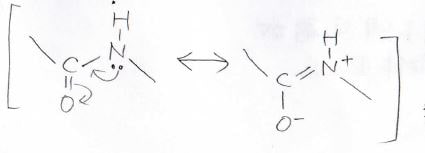
こういった例外がありますので、ぜひ知っておいてください。
練習問題
はい、それでは最後練習問題をやって終わろうと思います。
ここに示す4つの化合物の立体構造を予想してください。
1.
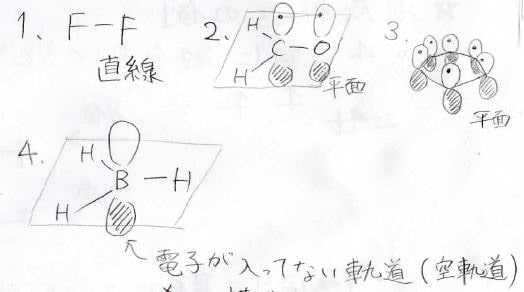
当たり前ですが、全ての二原子分子は直線型になります。
2.
σ結合が3本、孤立電子対が0ということでsp2混成となり、平面構造となります。
3.
ベンゼンは共鳴効果によりとても安定になっています。
もちろん平面構造です。
4.
σ結合3本、孤立電子対0で、合わせて3になるので、sp2混成、すなわち平面構造となります。
ここからは補足ですが、ボランのホウ素原子のp軌道には電子が1つも入っていません。
こういった軌道は空軌道と呼ばれ、電子を受け取る能力を有するLewis酸として働きます。
反応性に富む物質であるため、通常はLewis塩基であるTHF(テトラヒドロフラン)溶液にして、安定な状態で売られています。
まとめ
それでは今回の内容は以上ですので最後軽くおさらいをやって終わります。
今回は混成軌道の考え方と、化合物の立体構造を予測する方法をお話ししました。
混成軌道は現象としてそういうものがあるというより、化合物を理解するうえで便利な考え方だと考えてください。
混成軌道を作るときには、始めに昇位が起こって、不安定化しますが、最終的に安定化の効果を最大化するために昇位してもよいと考えます。
そして、σ結合と孤立電子対の数の和が混成軌道を考えるうえで重要になっていまして、それが4の時はsp3混成で四面体型、3の時はsp2混成で、平面構造、2の時はsp混成で直線型になります。
残ったp軌道は混成軌道と垂直な方向を向くことで電子間反発が最小になります。
ただし、このルールには例外があって、共鳴構造を取った方が安定になる場合には、たとえσ結合と孤立電子対の数の和が4になってもsp2混成で平面構造を取ることがあります。
アミド結合の窒素原子は平面構造だということはとても大事なことですからぜひ知っておいてください。
それではここまでお付き合いいただき、どうもありがとうございました!



