こんにちは!
それでは今回も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(chemical equivalence)
NMRの原理についてはこちらの記事をご覧ください。

では内容に入っていきます!
前回のおさらい
まず、以前やった化学シフトについておさらいします。
化学シフトとは、外部磁場の大きさによって変わるNMRの共鳴周波数を物理定数にして扱いやすくしたものです。
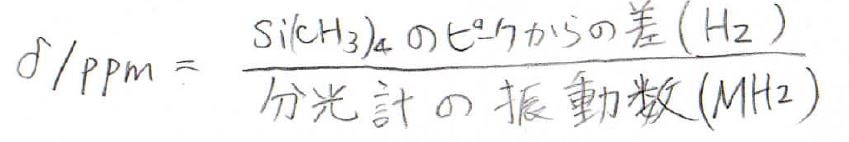
多くの場合、その基準はテトラメチルシランのピークで、これと目的のピークの共鳴周波数の差を分光計の周波数で割ったものが化学シフトになります。
この化学シフトを調べることで、官能基の存在を推測することができます。
例えば、化学シフトが\(1\sim 2\ \rm{ppm}\)の場合はアルキル基、\(3\sim 4\ \rm{ppm}\)の場合はアルコールやエーテル、ハロアルカンの\(\displaystyle \alpha\)水素であることが予想できます。

詳しくはこちらをご覧ください。

しかし、NMRでわかるのは官能基の存在だけかと言えば、実際はもっと多くのことがわかります。
そのことについて、今回と次回の2つの記事で説明していきます。
次回の記事はこちら。

化学的等価性
まず、NMRスペクトルの見方として、重要な概念である化学的等価性というものについてお話しします。
等価性というのは同じという意味で、等価な水素原子の化学シフトは同じ値になります。
そのため例えば、分子内に水素原子が10個あったとしても、ピークの数は1本や2本になる場合があります。
ここからは、何をもって化学的に等価と言えるのかということをお話しします。
回転対称
まず、1つ目は回転したときに元の構造と一致してしまう、すなわち回転対称な場合、回転させて重なる原子どうしが化学的に等価となります。
例えばエタンの場合、\(\displaystyle \rm{C-C}\)結合を回転軸にして\(120^\circ\)回すと、元の形とぴったり重なります。
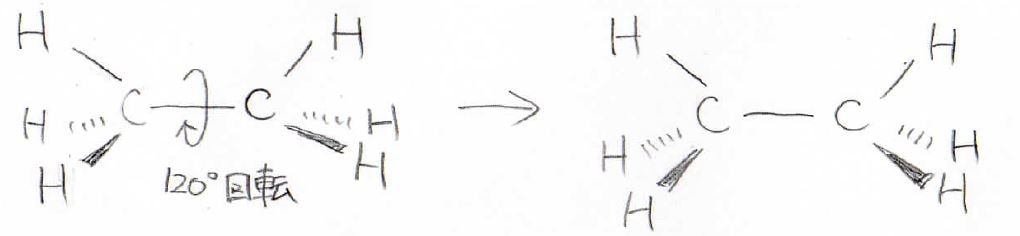
この場合、水素原子を区別することはできないので等価ということになり、すべての水素原子が同じ化学シフトの値になります。
そしてn-ブタンの場合でも、\(\displaystyle \rm{C-C}\)結合に対する垂直二等分線を軸に\(180^\circ\)回転させます。
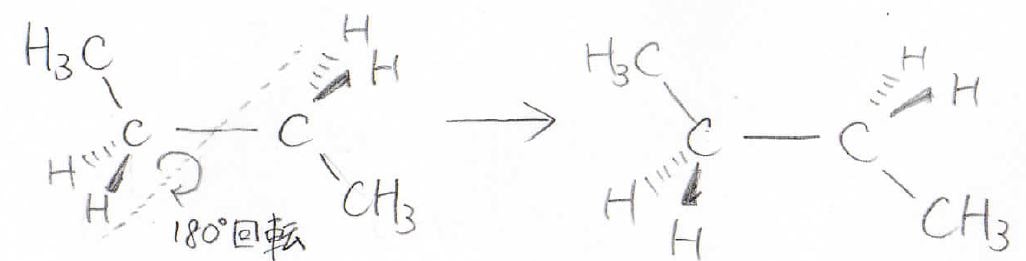
すると末端の水素どうし、末端ではない水素どうしがそれぞれ重なります。
この場合、2組の等価な水素の組み合わせがあるので、NMRのピークは2本現れることになります。
ちなみに、\(120^\circ\)回転したときに元の形と重なることを三回回転対称、\(180^\circ\)回転で重なることを二回回転対称と言います。
これは、\(360^\circ\)を何分割しているかというのを数字で表しています。
詳しくはこちらを参照してください。

鏡映対称
続いて、化学的に等価を見分ける方法の2つ目は、鏡映対称なものです。
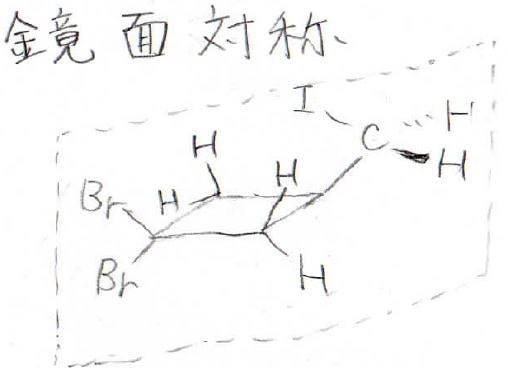
こちらの化合物を例にすると、図のような対称面を分子内に置くことができるので、この面を挟んで対称な原子どうしは、化学的に等価であることになります。
配座の交換による平均化
そして、等価になる3つ目の要因は、立体配座の速い交換によって平均化が起こるケースです。
例えばクロロエタンでは、このような立体配座の組み換えが起こっています。

仮に、左の構造について考えますと、塩素に対してアンチかゴーシュかで電子密度が異なるはずなので、\(\displaystyle \rm{H_b}\)だけが大きく反遮蔽化され、\(\displaystyle \rm{H_a}\)、\(\displaystyle \rm{H_c}\)より大きな化学シフトの値をとることが予想されます。
しかし、実際に測定してみるとピークは1本しか観測されません。
それは、これら3つの配座の交換が、NMR測定の時間スケールに対してとても速いために、その平均化が起こって区別できなくなるからです。
別の例として、シクロヘキサンでも似たことが言えます。
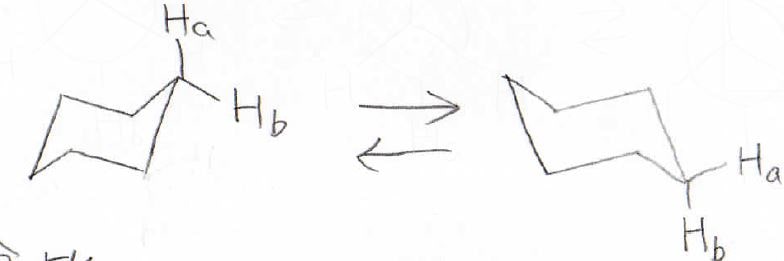
安定なイス型の立体配座を取っているときに、本来はアキシアル位とエクアトリアル位で非等価になるはずですが、もう1つのイス型と速い交換が起こっているため、実際に観測されるNMRのピークは1本になります。
ピークの積分比
そして最後の話題ですが、NMRスペクトルのピーク面積を積分によって求めると、実は化学的に等価な水素の個数比がわかります。
2,2-ジメチル-1-クロロプロパンを例にお話しすると、まず化学的に等価な水素の組み合わせは、末端の水素9個と\(\displaystyle \alpha\)水素2個で2組になります。
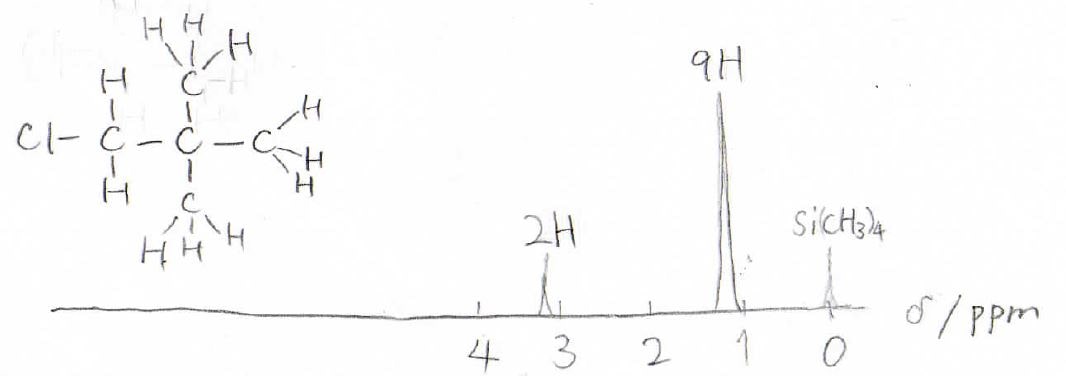
そのため2本のピークが観測されることになり、\(\displaystyle \alpha\)水素の方が大きく反遮蔽化されているので低磁場側にピークが現れます。
そして、実際のスペクトルを模して書いたのが上図で、末端の水素のピークはとても大きく出ます。
これらのピークを積分して面積を出すと、個数比が9:2だとわかります。
ただし、NMRでわかるのはあくまで等価な水素原子の個数比であり、実際の水素の個数は、元素分析や分子量の測定を行うことで決めることになります。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!