こんにちは!
それでは今回も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(alkene characteristics)
それでは内容に入っていきます!
\(\displaystyle \pi\)結合について
以前の記事でもお話ししましたが、\(\displaystyle \rm{C=C}\)結合の1本は\(\displaystyle \sigma\)結合、もう1本は\(\displaystyle \pi\)結合になります。

詳しくはこちらの記事をご覧ください。
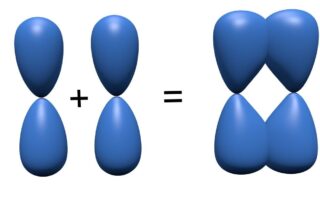
\(\displaystyle \sigma\)結合の方が軌道の重なりが大きく、より安定な軌道を作ることができるため、ポテンシャル図はこのようになります。
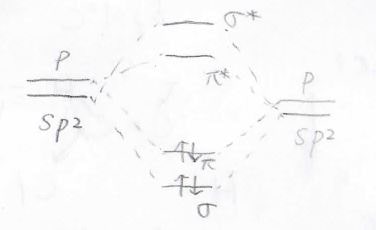
\(\displaystyle \pi\)結合だけの結合エネルギーを知るためには、熱異性化させます。
シス体よりもトランス体の方が立体反発が小さく、熱力学的に安定になるため、\(\displaystyle \sigma\)結合が切れない程度に熱を与えると、下のような反応を起こすことができます。
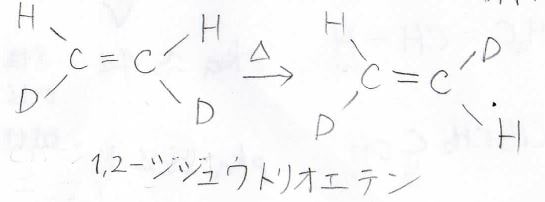
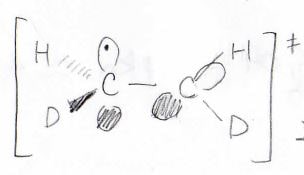
ここで、遷移状態では\(\displaystyle \pi\)結合が一度切れているため、この活性化エネルギーが\(\displaystyle \pi\)結合だけの解離エネルギーになります。
上記の1,2-ジジュウトリオエテンでは熱異性化は\(\displaystyle 400^\circ \rm{C}\)以上でなければ起こらず、活性化エネルギーは\(\displaystyle 272\ \rm{kJ/mol}\)となりました。
\(\displaystyle \rm{C=C}\)結合の\(\displaystyle DH^\circ\)(解離エネルギー)は\(\displaystyle 724\ \rm{kJ/mol}\)、エタン中の\(\displaystyle \rm{C-C}\)単結合の\(\displaystyle DH^\circ\)は\(\displaystyle 377\ \rm{kJ/mol}\)であり、\(\displaystyle 724-272=452\gt 377\)となるので、二重結合中の\(\displaystyle \sigma\)結合の解離エネルギーは単結合のものより大きいことになります。
二重結合の方が結合距離が短いため、軌道の重なりがより大きくなり、\(\displaystyle \sigma\)結合1本だけで比べても二重結合のほうが強い結合になります。
二重結合による違いはこれだけでなく、アルケニル炭素とほかの原子との\(\displaystyle \sigma\)結合もアルキル炭素とのものより強くなります。
これは混成軌道を考えていただくとわかります。
\(\displaystyle \rm{sp}\)\(^3\)混成軌道は\(\displaystyle \rm{s}\)軌道1つと\(\displaystyle \rm{p}\)軌道が3つを混ぜてできたものであり、\(\displaystyle \rm{sp}\)\(^2\)混成軌道は\(\displaystyle \rm{s}\)軌道1つと\(\displaystyle \rm{p}\)軌道2つでできた軌道です。
詳しくはこちらの記事をご覧ください。

両者を比べると、\(\displaystyle \rm{sp}\)\(^2\)軌道のほうが\(\displaystyle \rm{s}\)軌道の割合が大きいことになります。
そして、\(\displaystyle \rm{s}\)軌道は\(\displaystyle \rm{p}\)軌道よりも軌道の広がりが小さいため、\(\displaystyle \rm{sp}\)\(^2\)軌道は\(\displaystyle \rm{sp}\)\(^3\)軌道よりも電子密度が大きいということになります。
これを化学の言葉で、\(\displaystyle \rm{s}\)性が大きいと表現します。
電子密度が大きいほうがより強固な共有結合を作ることができるため、アルケニル炭素から伸びる単結合も強くなります。
アルケンの物性
ここからは、アルケンの物理的性質を見ていきましょう。
沸点
まずは沸点です。
液体がどれだけ安定かということで沸点は決まるのですが、その作用はLondon力で決まります。
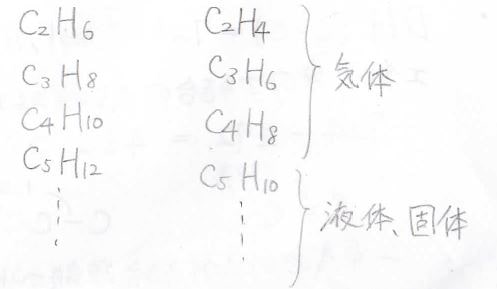
London力は表面積に依存しますが、炭素の結合様式が同じアルカンとアルケンでは表面積に大きな違いがないため、沸点は似た値になります。
その証拠に、アルカンではエタンからブタンまで常圧で気体、ペンタンからが液体、もっと大きくなると固体になりますが、エテンからブテンも気体、ペンテンからは液体というように近い傾向を示します。
融点
続いて、融点の違いです。
シス体とトランス体では結晶の安定性に特徴が見られます。
シス体ではU字型に湾曲した構造があることで、分子がきれいに並んでも立体的に歪んだ部分が結晶にできます。
トランス体ではこのようなことは起こらないため、シス体だけがトランス体や対応するアルカンに比べて低い融点をもつという傾向があります。
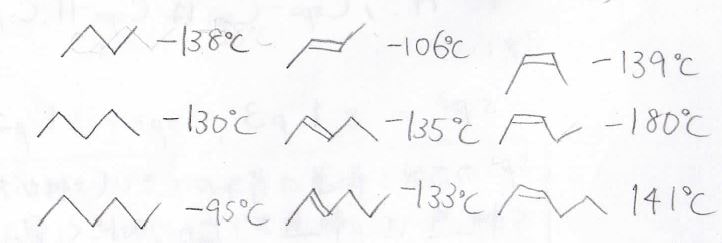
トランス脂肪酸という言葉をマーガリンの危険性などと一緒に聞いたことがあると思いますが、本来の植物油脂はそのほとんどがシス型の構造をもっているため、ココナッツオイルなどを除いた多くは常温で液体になります。
シス体は小さな双極子をもつ
ではこれが最後の話題です。
繰り返しになるのですが、\(\displaystyle \rm{sp}\)\(^2\)混成軌道は\(\displaystyle \rm{sp}\)\(^3\)混成軌道に比べて\(\displaystyle \rm{s}\)性が大きいため、軌道の広がりが小さいです。
\(\displaystyle \rm{sp}\)\(^2\)と\(\displaystyle \rm{sp}\)\(^3\)間で\(\displaystyle \sigma\)結合ができたときには、電子がアルケニル炭素側に少し偏在するため、小さな分極が起こります。

この双極子は二置換アルケン中に2つありますが、このようにトランス体では分子全体で打ち消しあうため、シス体のみが分子双極子をもつことになります。
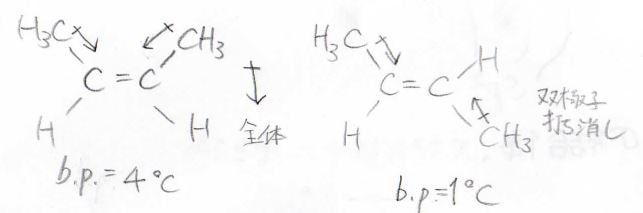
これにより、液体では永久双極子-永久双極子相互作用が生まれます。
この効果は、微妙な沸点の違いに現れます。
置換基が電子求引性のクロロ基だった場合には、先ほどと逆向きに大きな双極子ができますが、やはりトランス体では打ち消しあうため、シス体のみが分子双極子をもちます。
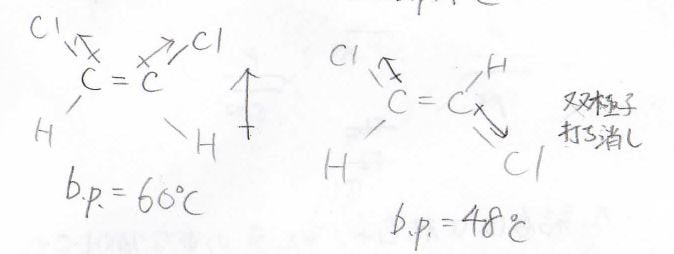
双極子が大きいため、相互作用も大きくなり、ジクロロエチレンでは\(\displaystyle 12^\circ \rm{C}\)も沸点に差が生じます。
酸性度
この分極の影響は、これだけではありません。
電子の偏りは水素原子のプロトン性を高めるため、アルキル水素とアルケニル水素では\(\rm{p}\)\( K_\rm{a}\)にこのような差が生じます。
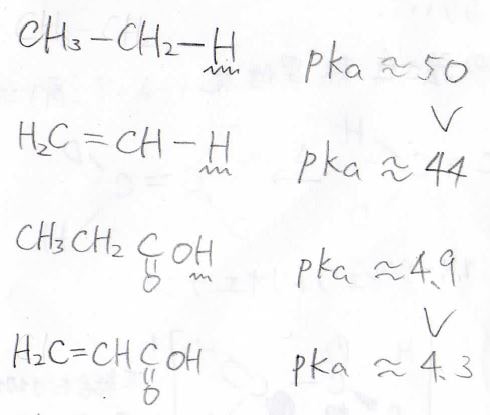
プロピオン酸とアクリル酸を比べても、\(\displaystyle \rm{sp}\)\(^2\)混成軌道の\(\displaystyle \rm{s}\)性の大きさを酸性度から見ることができます。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!




