こんにちは!
それでは今回も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(Saytzev)
それでは内容に入っていきます!
二分子脱離反応(\(\displaystyle \rm{E2}\)反応)とは
始めに、この\(\displaystyle \rm{E2}\)反応がどういう反応だったのかおさらいしていきます。
\(\displaystyle \rm{E2}\)反応は二分子脱離反応のことで、脱離基をもつ基質と強塩基との間で進行します。
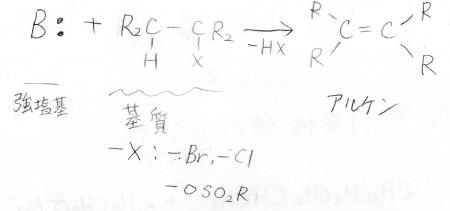
脱離基が付いた炭素に隣接している炭素についている水素原子を、塩基がプロトンとして引き抜くと同時に脱離基の脱離が起こることで、アルケンが生成します。
このプロトン引き抜きと脱離基の脱離は協奏的に進行し、反応速度が塩基と基質両方の濃度に比例する二次反応になります。
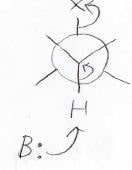
このように立体反発を避けた立体配座からアルケンの\(\displaystyle \rm{sp}\)\(^2\)混成に変わっていくため、引き抜かれるプロトンと脱離基はアンチの関係になります。
詳しくは別の記事でお話してますので、こちらを参照してください。
プロトン引き抜きの位置選択性
ここからが新しい内容になります。
まずは、\(\displaystyle \rm{E2}\)反応で引き抜けるプロトンが複数箇所にあった場合、どこが引き抜かれやすいのかということを考えます。
例えば、こちらの2-ブロモ-2-メチルブタンでは、末端の水素と3番の炭素上の水素で2パターン考えられ、できるアルケンも違うものになります。
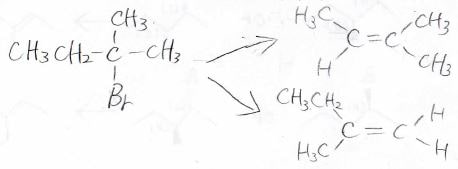
最初に結論から言うと、このプロトン引き抜きの位置選択性は塩基によって決まります。
例えば、塩基にエトキシドを使った場合、内部アルケンのほうが多く生成します。
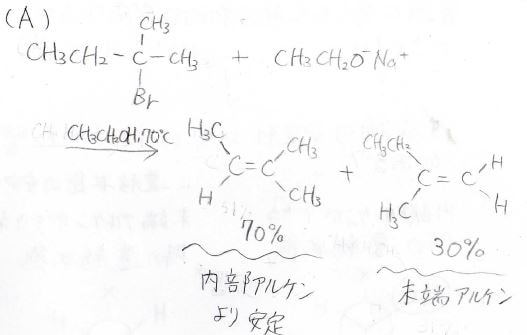
以前、アルケンの水素化熱の記事でもお話したとおり、\(\displaystyle \rm{sp}\)\(^3\)炭素の超共役により多置換アルケンのほうが熱力学的に安定で、この反応はその熱力学的な安定性から予想される結果と同じ傾向を示します。
詳しくはこちらを参照してください。
このように、\(\displaystyle \rm{E2}\)反応について、熱力学的により安定な内部アルケンができやすいという法則はSaytzev則と言います。
しかし、先述のとおり、この法則は塩基によっては成り立たなくなります。
仮に、塩基を嵩高いtert-ブトキシドを使った場合には、先程とは反対に末端アルケンのほうが多くできます。
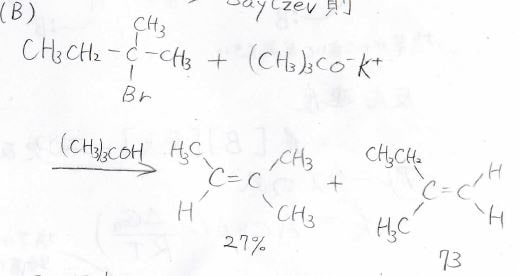
熱力学的な安定性に反して、\(\displaystyle \rm{E2}\)反応で末端アルケンのほうができやすいという法則はHofmann則と言います。
相反する法則が存在する理由
なぜ塩基が変わると真逆の傾向を示すのでしょうか?
一般的に考えれば、熱力学的に安定な内部アルケンのほうが多くできるはずなので、やはりHofmann則のほうが不自然です。
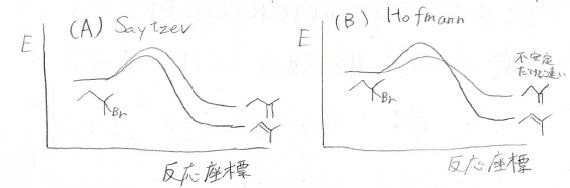
熱力学に反するということは、反応性を支配する別の要素があることを示唆しており、その答えは生成物ではなく遷移状態にあります。
末端アルケンができるときの遷移状態のほうが安定であれば、反応速度が速くなるため、その反応が有利になっていきます。
それぞれのアルケンができる前の遷移状態は下図のとおりで、内部アルケンができる反応では、塩基が立体的に込み合った部分に接近しなくてはいけません。
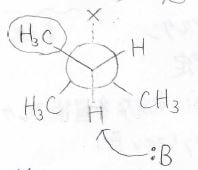
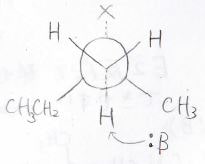
小さな塩基であれば、その障壁はほとんど関係ないですが、嵩高い塩基の場合にはここで大きな不安定化が起こります。
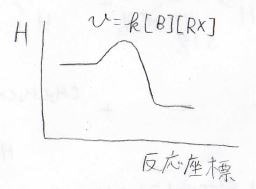
ここで、温度と圧力が一定での反応速度定数はアレニウスの式より、このように書けます。
![]()
\(\Delta G_\rm{a}\)が活性化ギブズエネルギー、\(k\)が反応速度定数です。
これをエンタルピー項とエントロピー項に分けたうちの、エンタルピーに塩基の嵩高さが関わってきて、より活性化エネルギーの低いほうが速くできることになります。
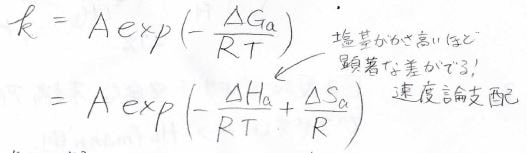
このように、反応速度の速いほうが優勢であることは、速度論支配であると言います。
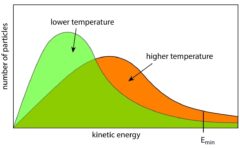
また、この式を見てもわかるとおり、温度を上げるほど両者のエンタルピーの違いはあまり効かなくなっていきます。
この場合は反応速度があまり変わらないので、塩基が嵩高くても生成物が熱力学的に安定な方が生成するようになります。
こういった場合は、熱力学支配であるといいます。
エトキシドを使ったAの反応とtert-ブトキシドを使ったBの反応のポテンシャル図は下図のとおりで、反応させる温度にもよりますが、遷移状態と生成物で安定性が逆転するとHofmann則に従う可能性があります。
幾何異性体の選択性
最後に、生成するアルケンにシス、トランスなどの幾何異性体が考えられる場合の選択性について考えます。
まず、こちらの2-ブロモペンタンにエトキシドを反応させたときには2-ペンテンのシス体とトランス体、そして1-ペンテンができますが、その生成比はここに示すようになり、トランス-2-ペンテンが最も多くできます。
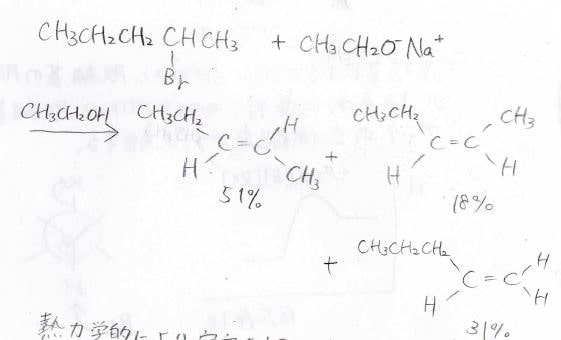
これにはトランス体の方が立体的な反発が少なく、熱力学的に安定であることが反映されています。
ただし、この\(\displaystyle \rm{E2}\)反応において、トランス体を\(\displaystyle 100\%\)与える組み合わせはほとんどなく、シス体もそこそこできます。
そのため、トランス体を\(\displaystyle 100\%\)作りたい場合には、別の反応を使うことがほとんどです。
ただし、三置換以上のアルケンのE体、Z体ができる場合には、基質によってできるアルケンが立体特異的になる場合があります。
例えば、こちらの2-ブロモ-3-メチルペンタンからできる3-メチル-2-ペンテンだけについて考えると、(R, R)体と(S, S)体はE体のみ、(R, S)体と(S, R)体はZ体のみを与えます。
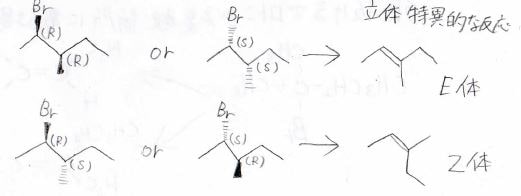
これはプロトンの引き抜きと脱離基の脱離がアンチ型の立体配座になってから起こることで見られる現象です。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!