こんにちは!
それでは今回も化学の話やっていきます。
今回のテーマは、こちら!
動画はこちら↓
動画で使ったシートはこちら(alkene reaction 1、alkene reaction 2、alkene reaction 3)
それでは内容に入っていきます!
(動画part1の内容)
付加反応の熱力学
まず、アルケンの特徴といえば二重結合を持っていることですが、\(\displaystyle \pi\)結合は\(\displaystyle \sigma\)結合に比べると、軌道の重なりが小さく弱いので、ここでいろいろ反応が起こります。
最初に、そのエンタルピー変化を考えておきましょう。


二重結合に\(\displaystyle \rm{A-B}\)という分子が付加する反応は、分割して考えると、\(\displaystyle \pi\)結合の解離、\(\displaystyle \rm{A-B}\)結合の解離、2本の\(\displaystyle \sigma\)結合形成となります。
したがって、それぞれの標準エンタルピー\(\rm{D}\)\(H^\circ\)を使うと、全体のエンタルピー変化\(\Delta H^\circ\)はこのように書けます。
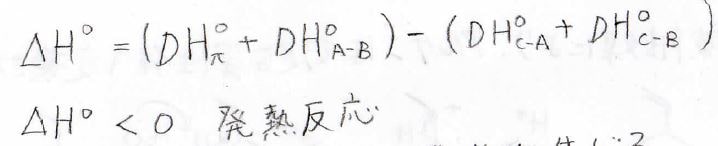
この\(\Delta H^\circ\)が負の値であれば発熱反応となり、安定な生成物が得られます。
実際、エチレンに水素を付加させたときのエンタルピーは下のように計算され、発熱反応となります。
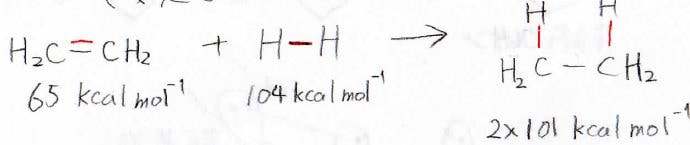
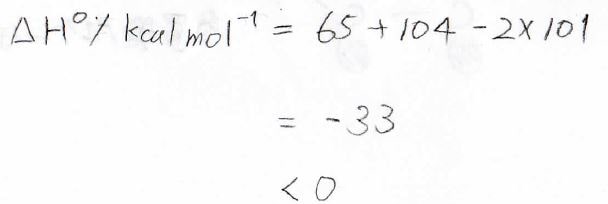
ただし、このエンタルピーの値は、\(\displaystyle \pi\)結合がなくなったことによる\(\displaystyle \sigma\)結合の強さの変化を考えない概算値です。
触媒存在下における水素付加反応の機構
エチレンに対する水素の付加反応が発熱反応とは言っても、エチレンガスと水素ガスを混ぜて\(200^\circ \rm{C}\)程度に加熱するくらいでは、エタンは生成しません。
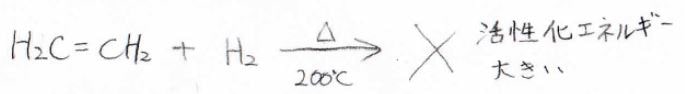
これは活性化エネルギーがとても大きいからであり、多くの場合は不均一触媒が使われます。
不均一触媒系では、触媒の表面で反応が起こります。
中学で習う過酸化水素と二酸化マンガンで、酸素が発生するという反応も不均一触媒系の例です。
よく使われるのは、こちらに示したパラジウム、白金、ニッケルなどを用いた触媒です。

不均一触媒の表面で起こる一連の反応は、次のとおりです。

まず、触媒表面に水素分子が近づいてくると、安定な\(\displaystyle \rm{H-H}\)結合を解離させて、このように表面に水素が結合した形になります。
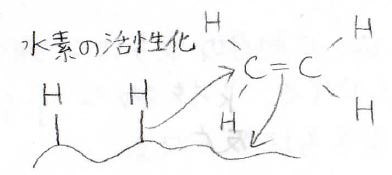
次に、アルケンの\(\displaystyle \pi\)電子が触媒と結合を作ります。
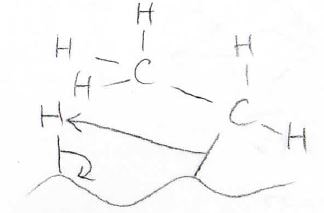
最後に、上記のような電子の移動が起こり、水素の付加反応が完了します。

この反応で不均一触媒は、安定な水素分子が解離した状態を安定化するはたらきをしています。
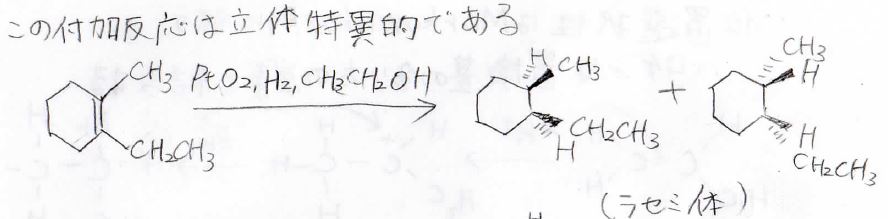
この触媒を用いた付加反応は立体特異的であり、例えば、下の1-エチル-2-メチルシクロヘキセンに対して、水素を付加させると、これら2つのラセミ混合物が得られます。
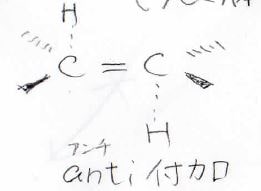
\(\displaystyle \pi\)結合を形成する炭素は、\(\displaystyle \rm{sp}\)\(^2\)混成で平面構造をとりますが、その平面に対して2つの水素原子は同じ方向から結合を形成します。
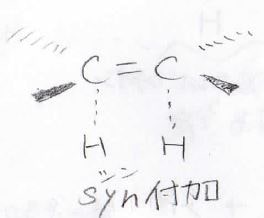
ただし、面の上から付くか下から付くかはランダムであるため、ラセミ体となります。
このような付加のしかたは、シン(syn)付加と言います。
これに対して、平面の反対側に付加する反応はアンチ(anti)付加と言います。
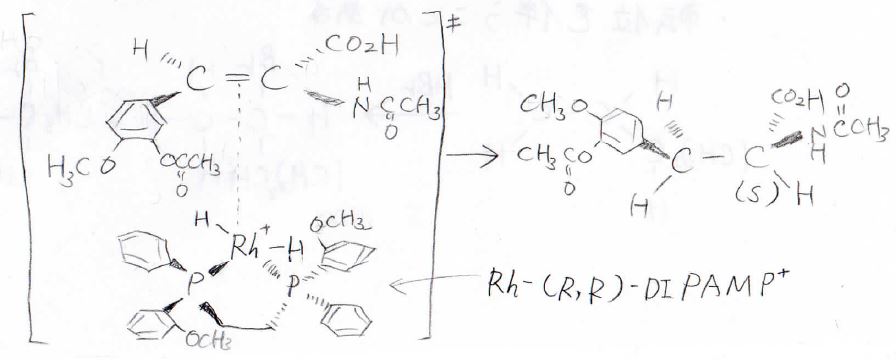
注意点として、触媒がキラルな場合は、選択的に一方のエナンチオマーが得られることもあります。
例えば、パーキンソン病の治療薬を工業的に作る過程では、キラルなロジウム触媒を均一系で作用させることで、\(\displaystyle S\)体を高い収率で得ています。
求電子付加反応
続いて、ここからは求電子付加反応について、お話していきます。
求電子付加反応とは、求電子剤との間で反応が起こることで進行する付加反応のことです。
\(\displaystyle \pi\)電子は原子からの拘束が弱いため、孤立電子対とまではいかなくとも、Lewis塩基のように求核的な挙動を示します。
ハロゲン化水素の付加
それではまず、最も簡単な求電子剤であるプロトンとの反応を見ていきます。
用いるのは、ハロゲン化水素です。
\(\displaystyle \pi\)電子がプロトンに攻撃することでカルボカチオンが生成し、それからハロゲン化物イオンが攻撃して、ハロアルカンが生成します。
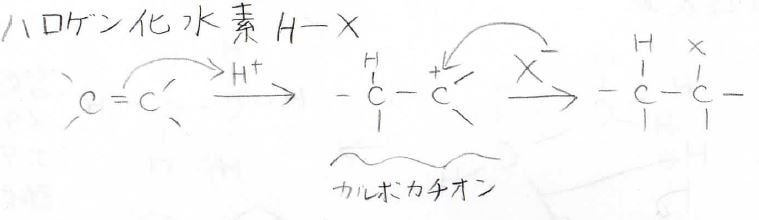
もちろん、カルボカチオン中間体を経由するため、立体は保持されません。
そして、この反応は逆に見ると\(\displaystyle \rm{E1}\)反応になります。
つまり、\(\displaystyle \rm{E1}\)反応と求電子付加反応は同時に起こり、化学平衡となります。
\(\displaystyle \pi\)結合を作っていた2つの炭素原子のどちらにハロゲンが付くのかには選択性があり、置換基がより多い方に付きます。
この法則は、Markovnikov(マルコフニコフ)則と呼ばれます。
その原理は、中間体であるカルボカチオンの安定性の違いから説明されます。
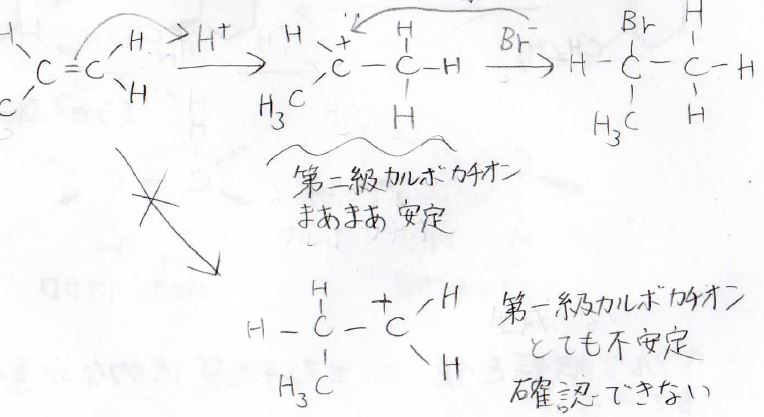
第一級より第二級、第二級より第三級のほうが超共役により安定となるため、プロトンは置換基の少ないほうの炭素原子に結合します。
それから、カチオン中心の炭素原子にハロゲン化物イオンが求核攻撃するので、Markovnikov則に従うことになります。
また、カルボカチオン中間体を経由するため、反応の途中で転位が起こる可能性があります。
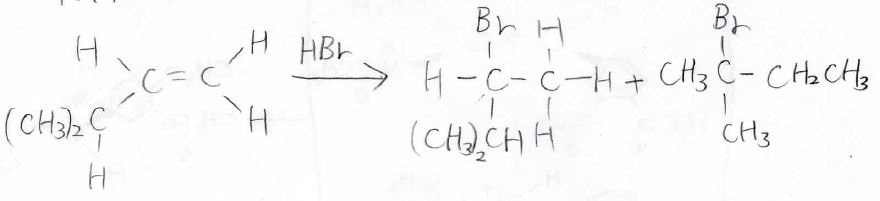
プロトンを用いた水和反応
続いて、プロトンを用いた求電子水和反応についてお話しします。
ハロゲン化水素同様に、希硫酸を使ってアルケンに水を付加させる反応は、\(\displaystyle \rm{E1}\)反応とその逆反応で、化学平衡となります。
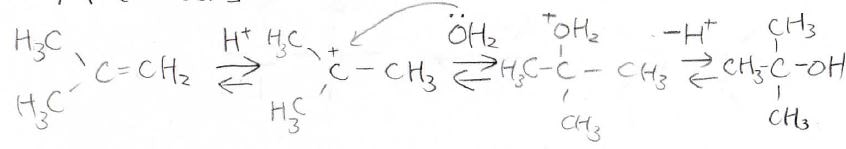
アルケンとアルコールのいずれに傾かせるかは、ルシャトリエの原理を利用して、水の量と温度でコントロールできます。

ルシャトリエの原理については、こちらを参照してください。

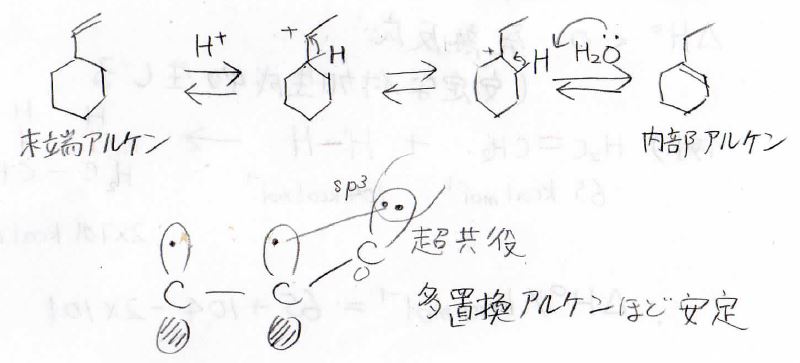
またここでは、カルボカチオンのときに転位が起こってからアルケンに戻るということも起こります。
多置換アルケンほど安定であるため、このような末端アルケンに酸を加えると内部アルケンに変換することが可能になります。
(動画2の内容)
ハロゲン分子の付加
四塩化炭素など安定なハロメタンを溶媒として、アルケンにハロゲン分子を反応させると、ジハロアルカンができます。
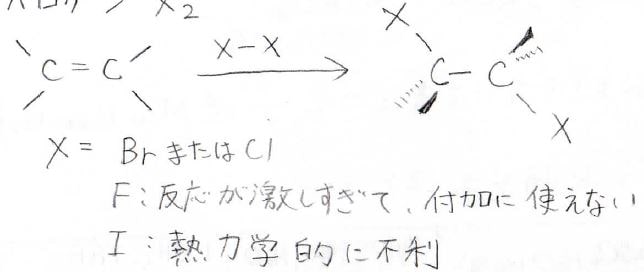
ただし、ハロゲンといっても塩素と臭素だけです。
フッ素では、一気に反応が起こってしまうため、うまく付加しません。
ヨウ素の場合は、\(\displaystyle \rm{C-I}\)結合が弱いため、熱力学的に不利になります。
そして、この反応は立体特異的であり、アンチ付加で進行します。
例えば、シクロヘキセンに臭素を加えると、このようなラセミ混合物が得られます。
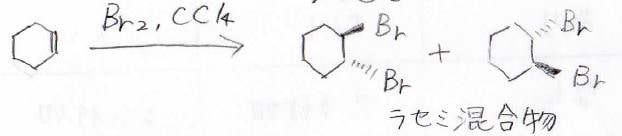
なぜ、アンチ付加なのかというと、次のような反応機構が考えられています。
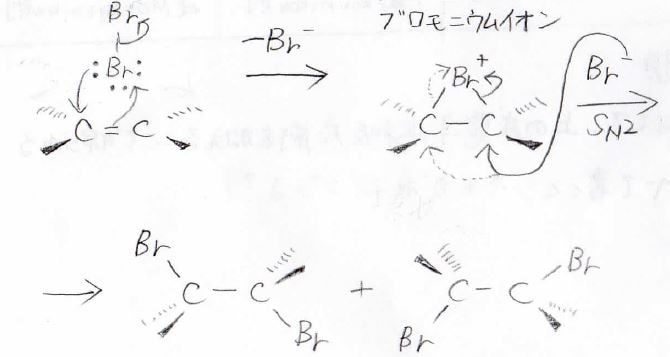
ここでは、ハロゲン分子の中で、一方の原子が正、もう一方が負に分極することを考えています。
\(\displaystyle \pi\)電子が正に分極したハロゲンに攻撃すると同時に、もう一方のハロゲン原子はイオンとして脱離することで、上のような三員環のカチオンを形成します。
これを環状ハロニウムイオンと呼び、特に臭素の場合は環状ブロモニウムイオン、塩素の場合は、環状クロロニウムイオンと言います。
ここに、ハロゲン化物イオンが\(\displaystyle \rm{S_N2}\)機構で求核攻撃することで開環し、アンチ付加体が得られます。
ちなみに、臭素\(\displaystyle \rm{Br}_2\)は有色であるため、アルケンの存在を目で確認する試験にも利用可能です。
ハロゲン+ほかの求核剤(過剰量)
そして、環状ハロニウムイオンと反応する求核剤は、必ずしもハロゲン化物イオンである必要はなく、ほかの求核剤が過剰量ある場合には、ブロモ基(またはクロロ基)とその置換基がアンチ付加します。
例えば、水を溶媒にして臭素を付加させようとすると、水が求核剤となってブロモニウムイオンに攻撃し、ハロアルコールが生成します。
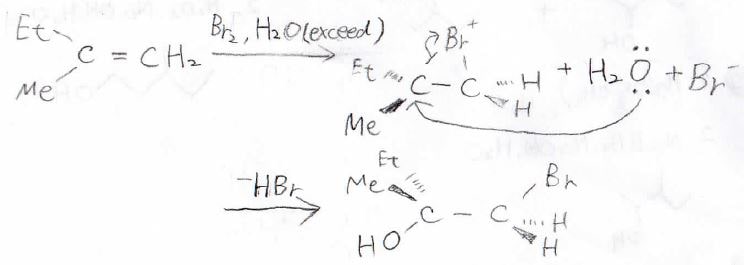
このとき、臭化水素が同時に生成します。
この反応は位置選択的でもあり、置換がより少ない方の炭素にハロゲンがつきやすいです。
これは、カルボカチオンの安定性により、置換の多い炭素が正に分極するからです。

同様に付加するほかの反応剤
また、アンチ付加する求電子剤は、ハロゲンの単体だけではなくて、ここに示したものでも同じように起こります。
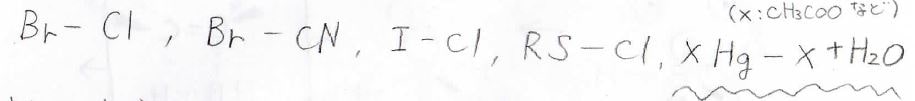
横線で示した単結合の左側が三員環のカチオンを作る部分で、右側が求核剤になる部分です。
それぞれを\(\displaystyle \rm{A}\)、\(\displaystyle \rm{B}\)と表したとすると、2-メチルプロペンには、下のように付加したものが選択的に得られます。

上述の反応剤の中で、いちばん右に書いている水銀塩と水を使った反応は特に重要なので、次の節で詳しく説明します。
オキシ水銀化-脱水銀化
アルケンに酢酸銀などの塩と水を反応させると、下のようにヒドロキシ基と水銀がアンチ付加したアルキル水銀になります。
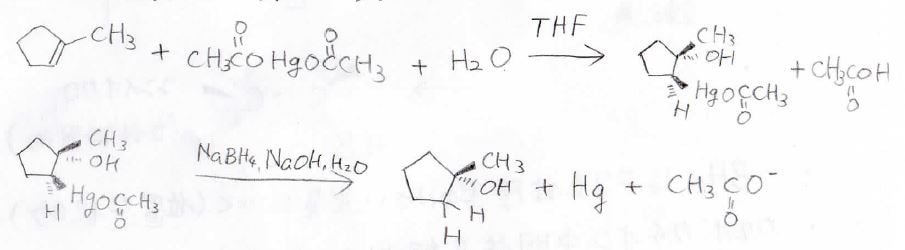
この反応をオキシ水銀化反応と言います。
さらにこの生成物は、ヒドリド還元剤である水素化ホウ素ナトリウムと反応させることで、水のアンチ付加体になります。
こっちの反応は脱水銀化反応と言います。
オキシ水銀化反応の中間体としては、このようなマーキュリニウムイオンができていると考えられています。

カルボカチオン中間体を経由しないため、転位が起こらず、生成物が複雑にならないという大きなメリットがあります。
そして、ヒドリドの求核攻撃はより立体障害の少ない方の炭素へ起こりやすいため、位置選択性はプロトン酸同様に、Markovnikov則に従うことになります。
ただし、水銀反応剤は高価かつ有害なため、扱いが難しいというのが、欠点になります。
ヒドロホウ素化-酸化
また、重要な求電子水和反応には、ヒドロホウ素化-酸化という方法があります。
求電子剤としては、Lewis酸であるボラン\(\displaystyle \rm{BH_3}\)を使います。
ボランは、それ自体で二量体を形成することでも知られる化合物で、Lewis塩基であるTHF(テトラヒドロフラン)などのエーテル溶液の形で販売されています。
溶液中では、このようなオクテット則を満たす安定な複合体を形成しています。
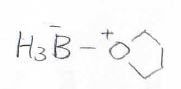
アルケンにボランを加えるときには、そのままTHFを溶媒にします。
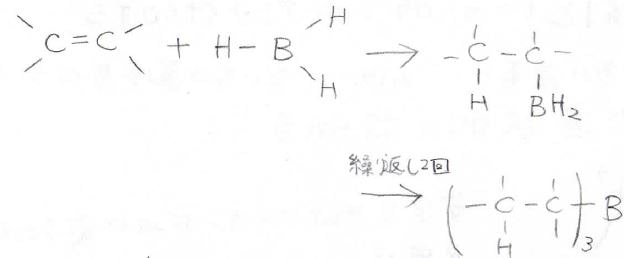
一方に水素、もう一方に\(\displaystyle \rm{BH_2}\)という形で求電子付加します。
この反応をヒドロホウ素化と言います。
この反応は、あと2回繰り返すことができて、最終的にはアルキルボランが得られることになります。
水素の付加とは異なり、触媒がなくても、この反応は進行します。
反応機構は以下のとおりで、\(\displaystyle \pi\)\電子がボランの空軌道に移ることで、四中心遷移状態を経て、付加が起こります。
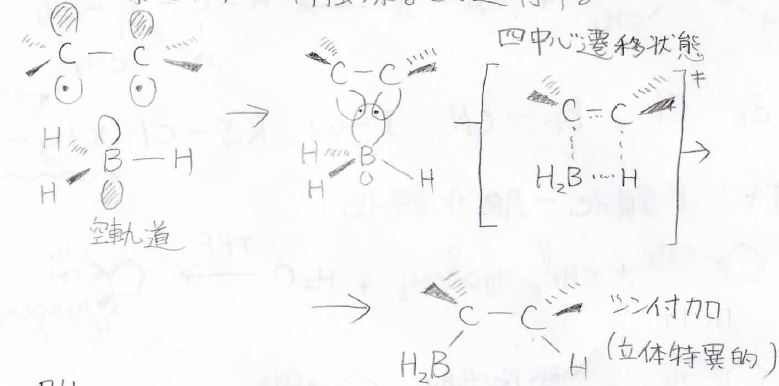
この反応は立体特異的であり、シン付加となります。
また、位置選択的でもあり、ホウ素は立体障害が小さいほうの炭素と結合します。
このようにしてできたアルキルボランは、塩基性条件下で過酸化水素などの酸化剤と反応させると、アルコールになります。
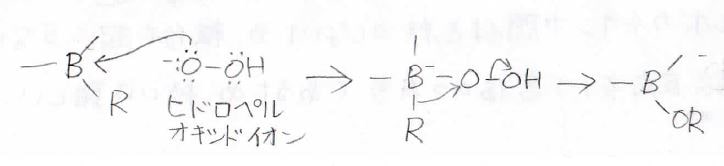
反応機構は以下のとおりで、まずアルキル基がアルコキシドに変換されます。
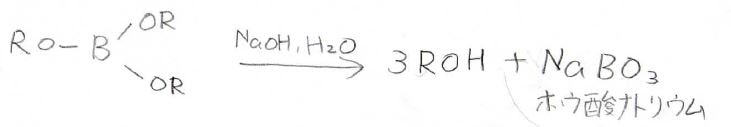
塩基によって加水分解されて、アルコールとなります。
また同時にホウ酸ナトリウムが生成します。
反応全体では、置換がより少ないほうの炭素にヒドロキシ基が選択的に結合するため、Markovnikov則の真逆になります。
この位置選択性はそのまま、逆Markovnikov則と言います。
3種の求電子水和反応まとめ
ここまでやってきた3種類の求電子水和反応の特徴をまとめておきます。

プロトン酸を使う反応は、カルボカチオン中間体を経由するため、複雑な生成物が得られる可能性があります。
対して、オキシ水銀化-脱水銀化およびヒドロホウ素化-酸化は、カルボカチオン中間体を経由しないため、転位が起こらず立体は保持されます。
立体特異性は、それぞれアンチ付加、シン付加になります。
位置選択性は、プロトンとオキシ水銀化-脱水銀化がMarkovnikov則、ヒドロホウ素化-酸化が逆Markovnikov則に従います。
(動画part3の内容)
カルベンを用いたシクロプロパンの合成
まずは、アルケンからシクロプロパンを作る方法からお話しします。
\(\displaystyle \pi\)結合部分を三員環にするためには、炭素がもう1個必要で、それにはカルベンという化学種を用います。
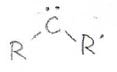
カルベンは、上に示すようなLewis酸で、例えば、ジアゾメタンに光や熱、銅などの触媒を作用させると、窒素分子が脱離し、最も簡単なカルベンであるメチレンが生成します。

実際のシス-2-ブテンとメチレンの反応はこのとおりです。

ヒドロホウ素化と同様に、Lewis酸の空軌道にアルケンの\(\displaystyle \pi\)電子が供与され、シクロプロパンになります。
この反応は、立体を保持したまま進行します。
また、\(\displaystyle \rm{C-C}\)結合を作る有用な反応の1つでもあります。
ジアゾメタン以外だと、クロロホルムからもカルベンを作ることができます。
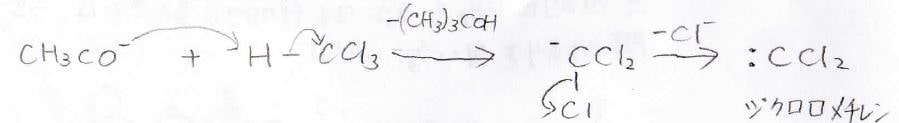
クロロホルムから強塩基によりプロトンを引き抜くと、さらに塩化物イオンが抜けて、ジクロロメチレンが生成します。
ほかには、カルベンではないがカルベンのような反応を起こせる化学種、カルベノイドというのがあります。
こちらのSimmons-Smith反応剤がその代表例です。
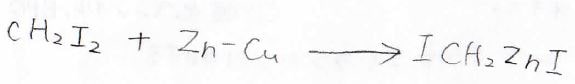
こちらは、塩酸と硫酸銅によって活性化された亜鉛とジヨードメタンから作ることができます。
トランス-2-ブテンとの反応は以下のとおりであり、メチレンを反応させたときと同じ生成物になります。
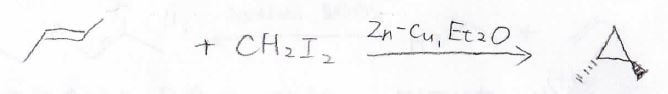
過酸を用いたエポキシ化
続いて、アルケンからオキサシクロプロパンを作る方法についてお話しします。
オキサシクロプロパンはエポキシドとも言うので、この反応はエポキシ化と言います。
使うのは過酸、すなわち普通の酸より酸素が1個多いものです。
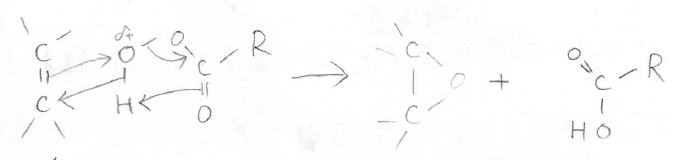
下記のペルオキシカルボン酸がその例で、実は、水素原子の隣の酸素原子は正に分極しているため、求電子的になっています。
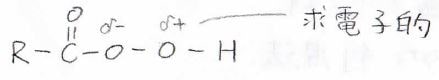
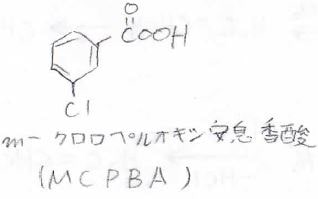
過酢酸でも反応は起こせますが、実験室で使われることが多いのは、こちらの\(\displaystyle m\)-クロロペルオキシ安息香酸、略してMCPBAというものです。
そして、もっと工業的に大規模でこの反応を起こす場合は、もう少し安定な反応剤を使います。

モノペルオキシフタル酸マグネシウム、略してMMPPというもので、通常は六水和物として売られています。
実際のトランス-2-ブテンとMCPBAの反応は下記のとおりで、立体は保持されます。
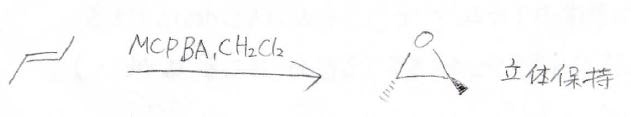
こちらが電子の動きで、求電子的な酸素原子上へ\(\displaystyle \pi\)電子の移動が起こります。
アルケンに2つ以上の二重結合があった場合は、1当量のMCPBAを加えたときに、置換がより多いほうの二重結合がエポキシ化されたものが選択的に得られます。
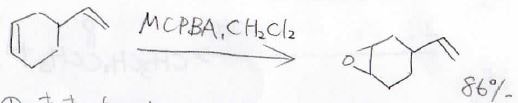
これは、超共役により多置換であるほど二重結合周辺の電子密度が大きくなっているためです。
隣接ジオールの合成
アンチ付加体
そして、オキサシクロプロパンは反応性が高いため、続けて開環反応を起こすことができます。
特に、酸性水溶液で処理した場合は、下のように2つヒドロキシ基が隣接したジオールが得られます。
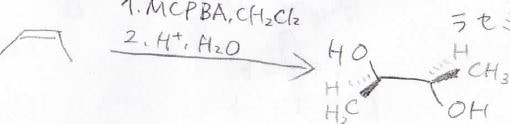
水の求核攻撃は\(\displaystyle \rm{S_N2}\)機構で進行するため、この反応は立体特異的であり、反応全体ではアンチ付加になります。
シン付加体
2つのヒドロキシ基をシン付加させる方法もあります。
使うのは、四酸化オスミウム\(\displaystyle \rm{OsO_4}\)です。

この反応は酸化還元反応であり、オスミウムは8価から6価へ還元されます。
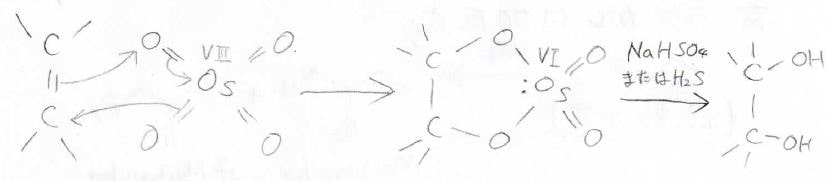
この生成物を硫化水素や亜硫酸水素ナトリウムで還元的に分解することで、隣接シンジオールとなります。
ただし、オスミウム反応剤は高価かつ毒性も非常に高いため、扱いは難しいです。
そのため、過酸化水素などによる再酸化で、触媒量に抑えるなどの工夫が必要となります。
また、四酸化オスミウム以外でも、過マンガン酸カリウム\(\displaystyle \rm{KMnO_4}\)で隣接シンジオールを作れることが知られています。
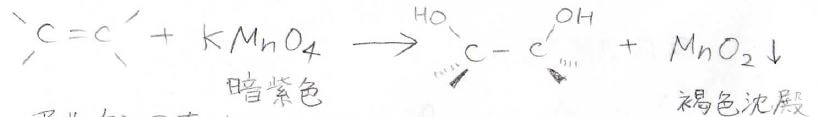
しかし、こちらは過剰酸化が起こるため収率が低いです。
そのため、隣接シンジオールを作るというより、アルケンの存在を確認する試験として、この反応は利用されます。
暗紫色の過マンガン酸カリウムが消費されると、溶液の色が透明に近くなり、同時に褐色沈殿として、二酸化マンガンが生成します。
オゾン分解
続いて、オゾン分解という反応の話をします。
オゾン層でよく知られるオゾン\(\displaystyle \rm{O_3}\)は、青色で生臭い匂いのする気体です。
実験室レベルでは、アーク放電により一部の酸素分子からオゾンが作られます。

このようにして作ったオゾンと酸素の混合気体は、メタノールまたはジクロロメタン溶媒中で、アルケンと反応します。
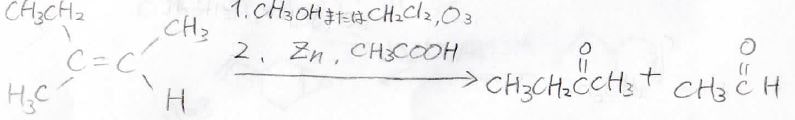
これを硫化水素、または亜鉛と酢酸により還元すると、アルケンの二重結合だった部分が解離して、2つのカルボニルになります。
反応機構はこのとおりです。

まず、\(\displaystyle \pi\)結合の電子がオゾンに供与されると同時に、オゾンからも電子対がアルケン側へ移り、上段真ん中の中間体となります。
これはモルオゾニドというもので、一次オゾニドまたは初期オゾニドとも呼ばれます。
ただし、これは\(\displaystyle \rm{O-O}\)結合が2つもあるため不安定で、さらに構造の組み換えが起こります。
そうしてできるのが、下段真ん中のオゾニドです。
これに還元剤である硫化水素または亜鉛と酢酸を加えると、酸素原子が1個外れて、2つのカルボニルが生成します。
この反応は、炭素同士の\(\displaystyle \pi\)結合だけでなく、\(\displaystyle \sigma\)結合も切るのが特徴的な点で、炭素数を減らすのに有用な反応です。
ラジカル付加反応
続いて紹介するのは、ラジカル付加反応です。
まずおさらいとして、アルケンに臭化水素が求電子付加する場合は、位置選択性はMarkovnikov則に従い、置換がより多い炭素側へ臭素が結合します。
しかし、何も考えないでこの反応をやろうとすると、下のように逆Markovnikov則に従った生成物がたくさんできてしまうことがあります。
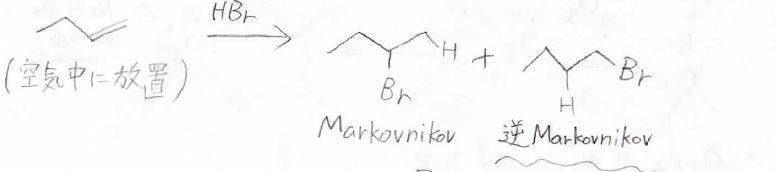
その原因は、過酸化物の存在にあります。
アルケンは空気中に放置すると酸化して、一部が過酸化物となってしまうのですが、精製してこれを取り除かないと、ラジカル的な反応が起こってしまいます。
その結果、逆Markovnikov則に従った生成物ができてしまうというわけです。
反応機構はこのとおりで、開始段階では過酸化物がホモリシス開裂し、それから臭素原子が生成します。

そして、臭素原子は安定なラジカルができるようにアルケンと結合を作るため、置換のより少ない炭素側に付きます。
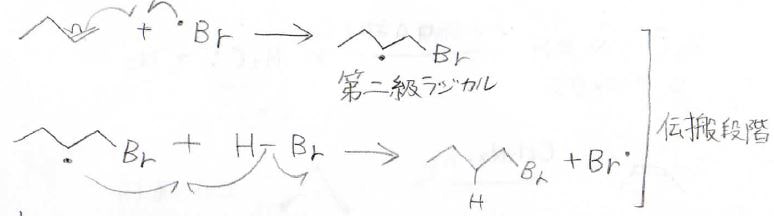
このようにしてできた第二級ないし第三級ラジカルは臭化水素から水素原子を引き抜き、また臭素原子を発生させるというサイクルで、反応は伝播していきます。
ラジカル同士が出会って消滅する停止反応が起こるまで、このサイクルを繰り返します。
ここで注意したいのは、塩化水素やヨウ化水素では、このラジカル付加反応は起こらないということです。
どちらも熱力学的に不利なため、空気中に放置したアルケンと反応させても、Markovnikov則に従った生成物のみが得られます。
ラジカル付加反応が起こる別の反応剤としては、チオールがあります。
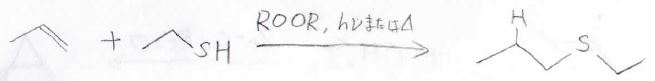
意図的にラジカル付加反応を起こしたい場合は、あらかじめ過酸化物やアゾ化合物を入れておくということもあります。
代表的なラジカル開始剤としては、こちらにあるような化合物です。

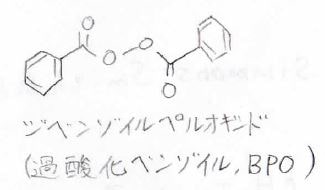
あとは、アゾビスイソブチロニトリル、略してAIBNというものも有名です。
高分子の合成(重合反応)
アルケンは高分子の材料になります。
連鎖重合という様式の反応では、活性な末端に次々とアルケンが結合していき、ポリマーが生成します。
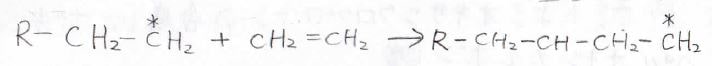
詳しくは、こちらを参照してください。
エチレンの工業的な利用例
最後、あまり試験で聞かれない内容ですが、エチレンの工業的な利用方法について、軽くお話しします。
エチレンは石油を原料として得ることができますが、そこからWacker法によりアセトアルデヒドを作ることができます。

反応に用いるのは、水と酸素、そして触媒である塩化パラジウム(II)と塩化銅(II)で、水素原子1つをヒドロキシ基に置換し、ケト-エノール平衡によりアルデヒドができるという反応です。
また、エチレンに塩素分子をアンチ付加させた後、熱をかけると塩化水素を取り出せて、クロロエチレンを得ることができます。
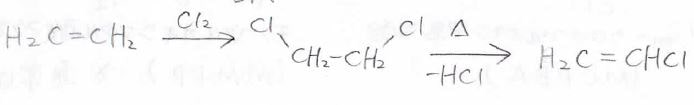
そして、エチレンに銀触媒とともに酸素を反応させることでも、オキサシクロプロパンを作ることができ、これを酸で処理することでエチレングリコールを作ることができます。
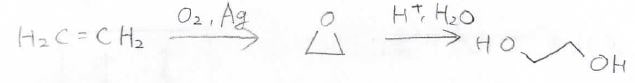
エンジンの不凍液として知られているポリエチレングリコール(PEG)の原料としても、重要な化合物です。
練習問題
それでは最後に練習問題をやってみましょう!
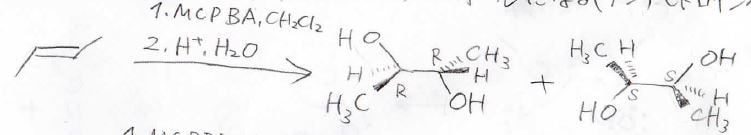
1. 3-メチル-1-ペンテンに対して、上記の求電子水和反応剤3種類を反応させると、どのような生成物が得られるでしょうか?
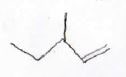
2. 左の化合物から右の化合物を合成するまでの経路を考えてください。
ただし、光学異性体は考えなくてよいものとします。
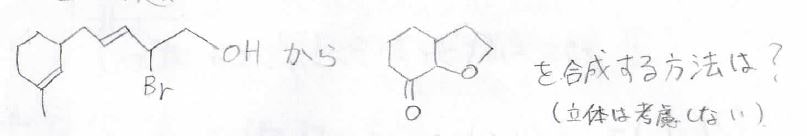

まず①、低温条件で希硫酸を反応させると、Markovnikov則に従って3-メチル-1-ペンタノールが得られます。
また、カルボカチオンの転位を伴って、3-メチル-3-ペンタノールも生成すると考えられます。
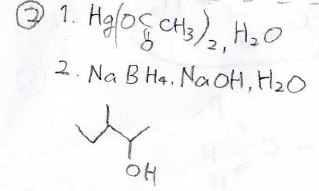
②オキシ水銀化-脱水銀化では、カルボカチオン中間体を経由しないため、転位が起こりません。
したがって、Markovnikov則に従った3-メチル-1-ペンタノールが高い収率で得られます。

③ヒドロホウ素化-酸化では、逆Markovnikov則に従って、3-メチル-1-ペンタノールが得られます。
2. 今回は、これまでの記事でやってきた反応だけで考えた例を示します。
それでは、逆合成解析のプロセスで、生成物から辿っていきます。
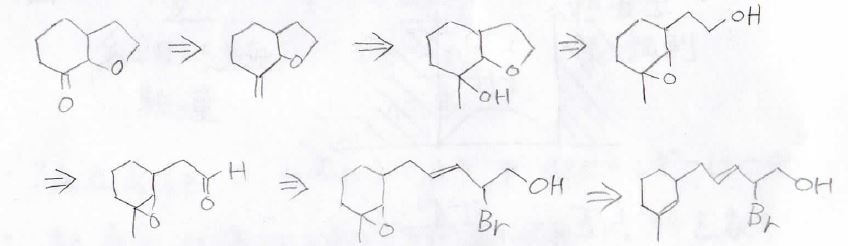
まず、原料と最終生成物では炭素数が異なるため、オゾン分解によって数を合わせることを考えることにします。
二重結合は、アルコールの脱水反応で作ることを考えます。
ただし、この第三級アルコールに濃硫酸を加えても末端アルケンの選択性は低いので、注意が必要です。
環状構造は、オキサシクロプロパンへアルコキシドの分子内\(\displaystyle \rm{S_N2}\)反応を起こさせることで作れます。
まだ炭素数は足りていないので、もう一度オゾン分解することを考えると、この前の構造はアルデヒドになります。
あとは、オキサシクロプロパンが二重結合になれば、原料の化合物になります。
これをひっくり返すと、このようになります。
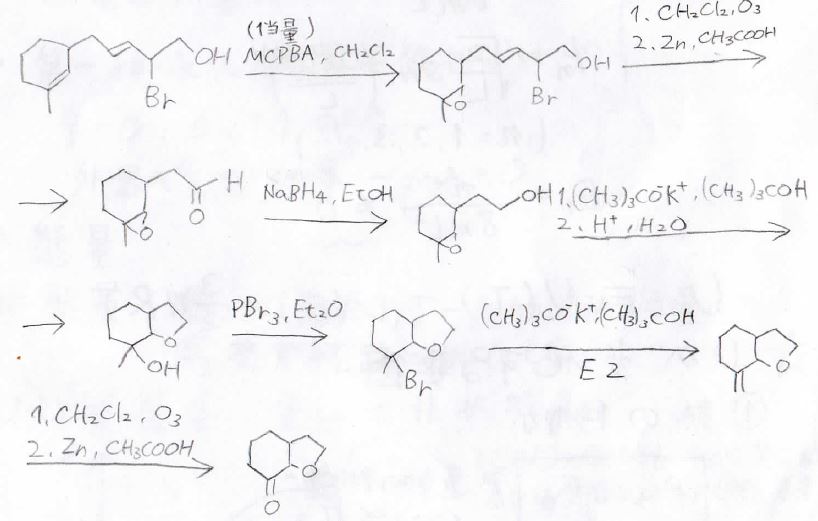
まず過酸による位置選択的なエポキシ化から、オゾン分解をします。
それから、水素化ホウ素ナトリウムによるヒドリド還元でアルデヒドをアルコールに変換します。
このとき、水素化アルミニウムリチウムを使うと、オキサシクロプロパン環も開いてしまうので、注意してください。
それから、嵩高い強塩基により求核攻撃を防ぎつつ、アルコキシドを作り、オキサシクロペンタン環を作ります。
そして、ヒドロキシ基のままだと末端アルケンを選択的に得られないので、三臭化リンにより、ヒドロキシ基をブロモ基に変換して、嵩高い強塩基により\(\displaystyle \rm{E2}\)反応させます。
あとは、これをオゾン分解すれば、目的の生成物になります。
まとめ
はい、今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!






