こんにちは!
それでは今日も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(allylic position)
アリル型中間体の安定性
まず、アリル位とは、炭素数が\(\displaystyle 3\)以上のアルケンについて、二重結合の隣にある炭素の位置を指します。
ラジカル
アリル位にある水素原子は、通常の単結合に比べて、ホモリシス開裂しやすいことが知られています。
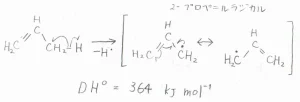
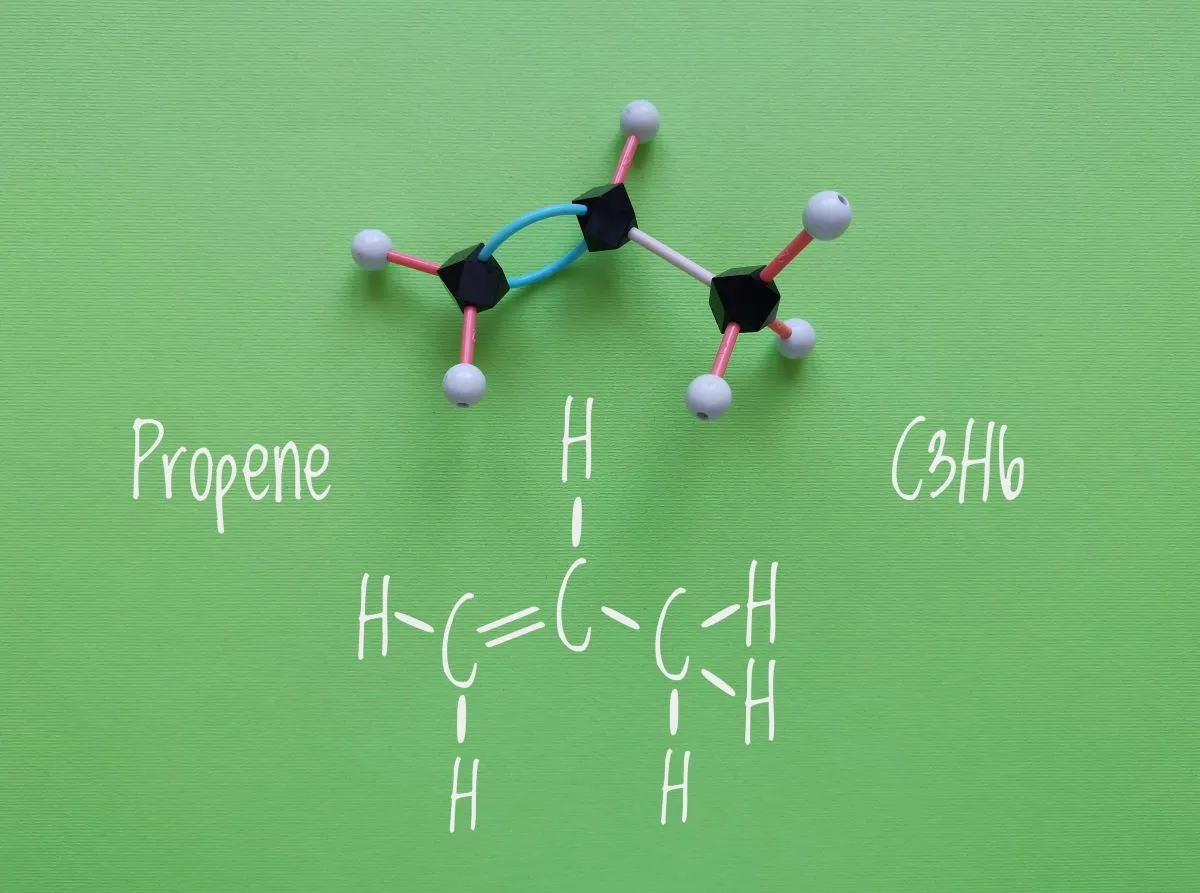
プロピレンについての結合エネルギーは、\(\displaystyle 364\ \rm{kJ\ mol}\)\(^{-1}\)となります。
アルカンの第一級炭素と水素の結合エネルギーは、\(\displaystyle 423\ \rm{kJ\ mol}\)\(^{-1}\)で、明らかにプロピレンのほうが結合が弱いことがわかります。
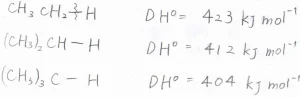
第二級炭素についての結合エネルギーは\(\displaystyle 412\ \rm{kJ\ mol}\)\(^{-1}\)、第三級については\(\displaystyle 404\ \rm{kJ\ mol}\)\(^{-1}\)で、生成するラジカルでは、3つのメチル基からの超共役を超える安定化が起こっていると言えます。
プロピレンから水素原子が抜けてできるラジカルは、2-プロぺ二ルラジカルと呼ばれ、こちらのように共鳴構造をとることで、安定化が起こっています。
カチオン
同様の現象は、ヘテロリシス開裂した場合にも見られます。
塩化アリルにメタノール溶媒中で熱をかけると、クロロ基がメトキシ基に置換されます。
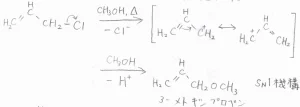
塩化物イオンが解離してできる2-プロぺ二ルカチオン中間体は、上式の共鳴構造をとります。
この反応は一分子の求核置換反応なので、\(\displaystyle \rm{S_N}\)\(1\)機構だと言えます。
アニオン
また、2-プロぺ二ルアニオンの安定性については、酸性度の比較が有用です。
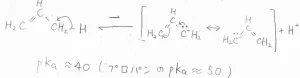
プロパンの末端水素の\(\displaystyle \rm{p}\)\(K_\rm{a}\)\(\)は、およそ\(\displaystyle 50\)です。
それに対して、プロピレンのアリル位にある水素の\(\displaystyle \rm{p}\)\(K_\rm{a}\)\(\)は、およそ\(\displaystyle 40\)となります。
これでも、酸と呼ぶには酸性度が低いですが、プロパンのおよそ10万倍もアニオンが生成しやすいと考えれば、その安定性が実感できると思います。
ヒュッケル法に基づく解釈
\(\displaystyle \pi\)電子共役系の安定化の度合いは、簡単にはヒュッケル法という方法で計算されます。
以前の記事で、アリル系についても計算しているので、その結果を使います。
導出過程については、こちらの記事を参照してください。
3つの炭素原子上の\(\displaystyle \rm{p}\)\(\)軌道にあった電子が非局在化して、3つの分子軌道ができます。

ここでは、エネルギーの低いものから、\(\displaystyle \pi_1\)、\(\displaystyle \pi_2\)、\(\displaystyle \pi_3\)軌道と呼ぶことにします。
右に書いてあるのが、分子軌道の図です。
一般的に、位相が入れ替わる節の本数が多いほど、エネルギーは高くなります。
\(\displaystyle \pi_1\)軌道は、電子の非局在化によって、もとの\(\displaystyle \rm{p}\)\(\)軌道より安定となったもので、結合性軌道と言います。
反対に、不安定となった\(\displaystyle \pi_3\)軌道は、反結合性軌道と言います。
\(\displaystyle \pi_2\)軌道は、中心の炭素原子が関与しておらず、安定化も不安定化もほとんど起こらないもので、非結合性軌道と呼ばれます。
基底状態における2-プロぺ二ルカチオン、ラジカル、アニオンの電子配置は、こちらに示したとおりです。
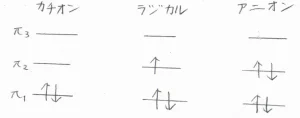
いずれも反結合性軌道である\(\displaystyle \pi_3\)軌道に電子がないため、電子が局在化しているときよりも安定となります。
また、先述のとおり、\(\displaystyle \pi_2\)軌道には中心の炭素原子が関与していないため、電荷密度分布の違いは、両端の炭素原子上に現れることになります。
カチオン、ラジカル、アニオンで、中心の炭素原子周辺の電荷密度には、あまり差がありません。
アリル位で起こる有機反応
ここからは、アリル型の中間体の安定性が影響して起こる反応について、見ていきます。
ラジカル的ハロゲン化
まず、プロピレンに塩素または臭素の分子を少量加えて、そこにラジカル開始剤となる過酸化物を添加するか、光を照射することで、水素がハロゲンに置換されます。

ハロゲンが高濃度のときには付加反応が起こり、環状のハロニウムカチオン中間体を経由して、隣接ジハロアルカンが生成するほうが支配的になります。
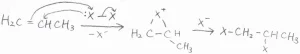
この反応については、こちらの記事を参照してください。
実験室で、効率よくアリル位のブロモ化をするときには、N-ブロモスクシンイミド(NBS)という反応剤を四塩化炭素に懸濁させて用います。
この化合物は、系に少量存在する臭化水素との反応により、臭素分子を少しずつ定常的に供給する役割をもちます。
その機構は、下記のとおりで、イオン的に進行します。反応後は、ブタンイミドと臭素分子が生成します。
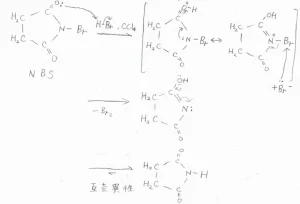
実は、NBSによって臭素化できるのは、アリル位のほかにベンジル位もあり、これらの反応のことは、ウォール-チーグラー反応と呼ばれます。
シクロヘキセンにNBSを反応させると、3-ブロモシクロヘキセンができます。
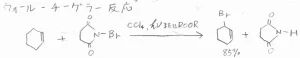
そして、塩素化については、熱的な過程によっても置換が起こる例があります。
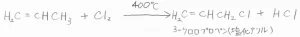
エポキシ樹脂などの合成ブロックとなる塩化アリルは、この方法で工業的に生産されています。
ハロゲン化アリルの求核置換反応
続いて、アリル位がハロゲン化された化合物の求核置換反応についてお話しします。
記事の前半で、すでに\(\displaystyle \rm{S_N}\)\(1\)反応を紹介しているので、ここでは\(\displaystyle \rm{S_N}\)\(2\)反応のみ紹介します。
アセトンを溶媒として、1-クロロプロパンにヨウ化水素を反応させると、カルボカチオンを経由せずに1-ヨードプロパンができます。
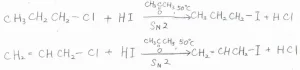
同様に、塩化アリルにヨウ化水素を反応させると、ヨウ化アリルができます。
どちらも温度を\(\displaystyle 50^\circ \rm{C}\)\(\)に統一したとき、アリル位の求核置換は、第一級炭素に比べて、およそ\(\displaystyle 73\)倍の速さで進行します。
これには、2つの理由があります。
まず、\(\displaystyle \rm{sp}\)\(^2\)炭素は\(\displaystyle \rm{s}\)\(\)性が大きく、電子求引性であるため、アリル位がより求電子的になっていたことが挙げられます。
そして、遷移状態で、3つのp軌道が平行に近い形となったことで非局在化に近い安定化が起こったというのが2つ目の理由です。
アリル型有機金属反応剤の合成
そして、アリル位にある水素は酸性度が高いので、アルカンに比べて有機金属反応剤にしやすいです。
n-ブチルリチウムを使って、アリル型リチウム反応剤を作る反応は、溶媒和が大きいN,N,N’,N’-テトラメチルエタン-1,2-ジアミン(TMEDA)を加えることで、さらに促進されます。
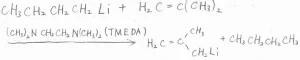
Grignard試薬も、禁水条件、THF溶媒中で冷却しながら臭化アリルとマグネシウムを混合して作ります。

これらは、求核剤としてはたらくことができるため、ハロアルカンやアルデヒドなどに攻撃させたうえで、さらに二重結合を別の官能基にできるという点で、有用な反応です。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、X(https://X.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!