こんにちは!
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(chemical shift)
では参ります。
NMRの原理をおさらい
まず、前回のおさらいを軽くやります。
一部の原子核は電子同様にスピンをもっており、外部磁場をかけることで原子スペクトルに変化が生じます。
これをゼーマン効果と言います。
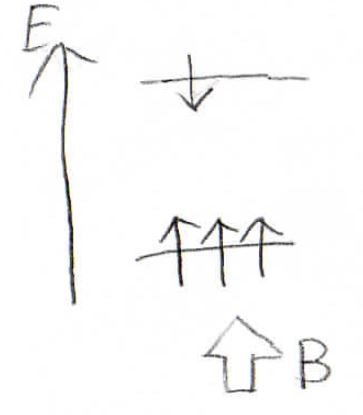
もともと縮退していた異なるスピン状態のエネルギー差に相当する波長の電磁波を吸収することでスピンが反転する現象を核磁気共鳴、略してNMRと言います。
一般的に原子核の周りには電子があるので、レンツの法則により外部磁場と逆向きに局部磁場が発生します。
この効果は、遮蔽化と呼ばれます。
詳しくは前回の記事を見てください。

反遮蔽化
ここからが新しい内容です。
まず、NMR分光法の測定を行うためには、スピンが\(\displaystyle 0\)ではない核種を使う必要があるのですが、特に使われるのが質量数\(\displaystyle 1\)の水素と質量数\(\displaystyle 13\)の炭素です。
そのため、これ以降は水素の原子核を前提にお話ししていきます。
電子の遮蔽化により、原子核が実際に感じる磁場の大きさは外部磁場に局部磁場の和になります。

外部磁場の大きさは人が設定する値で、分子全体にかかるので、官能基の識別に重要なのは局部磁場のほうです。
電子密度が大きいほど局部磁場が大きくなることから、官能基中の電子の偏りによって識別できるようになります。
エタノールを例に考えると、まず、等価な水素原子はヒドロキシ基の水素と\(\displaystyle \alpha\)水素と\(\displaystyle \beta\)水素で3種類あります。
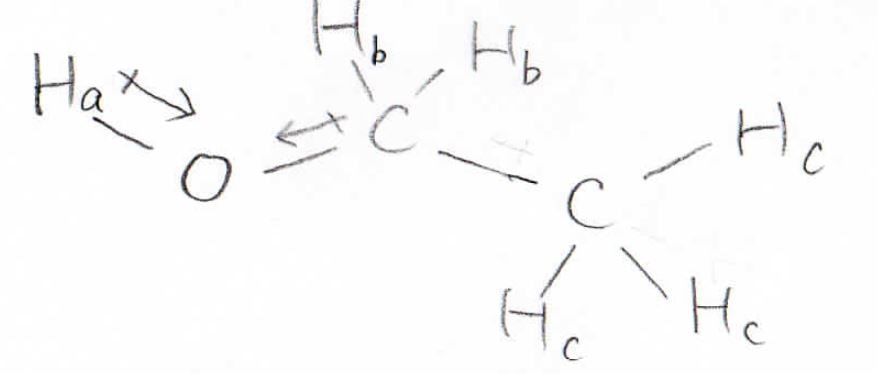
酸素は炭素や水素より電気陰性度が大きく、電子を引っ張るので、酸素原子の近くにある水素周辺の電子密度は小さくなります。
すると局部磁場が小さくなることで、分裂するエネルギーの幅が大きくなり、より高い周波数の電磁波を吸収することになります。
電子密度を小さくなることなどにより、原子核の周辺の磁場が大きくなることは、反遮蔽化と呼ばれます。
化学シフト
これにより、吸収される電磁波の振動数により官能基を見分けることができます。
ただし、2つのスピン状態のエネルギー差は外部磁場の大きさに依存しているため、吸収振動数は物質に固有の値になりません。
文献等で報告する際には、換算しなければいけません。
それだと都合が悪いので、何か基準の物質を決めて、吸収振動数の差を評価することにしました。

固有の物質定数である化学シフト\(\delta\)は、基準物質のピークと目的のピークの共鳴振動数の差を分光計の振動数で割った値として定義されます。
単位は\(\rm{ppm}\)です。
これはparts per millionの略で、\(10^{-6}\)という意味です。
多くの場合、基準物質にはテトラメチルシランを使います。
テトラメチルシランを使う理由はいくつもあって、等価な水素原子が12個もあって強いシグナルを得やすいこと、大きく遮蔽化されていることで、測定物質の吸収ピークと重なりにくいことなどがあります。
あとは反応性が低く、揮発性が高いなどの特徴があります。
例として、2,2-ジメチル-1-プロパノールの1H-NMRスペクトルは、下のようになります。
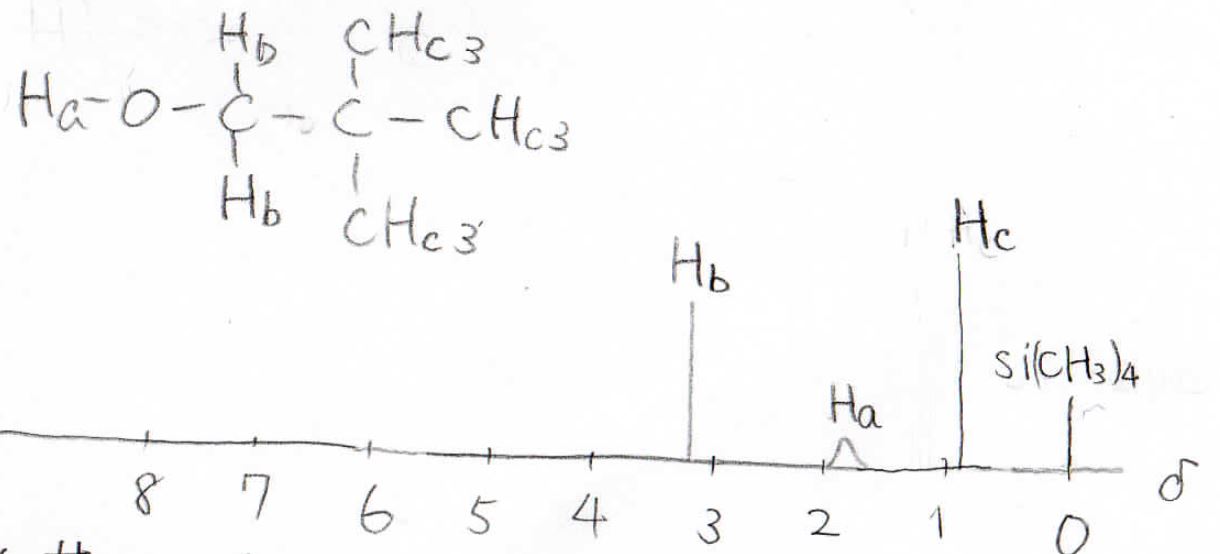
まず、\(\delta =0\)のところにピークがありますが、これがテトラメチルシランのピークで基準になります。
それで等価な水素原子は3種類あるので、得られるピークは3本になります。
この横軸の値が官能基を特定するヒントになります。
官能基と化学シフトの関係
最後に、官能基と化学シフトの関係を見ていきましょう。
ここに代表的な化学シフトの値を載せました。

化学シフトの表は有機化学の教科書なら必ず載っているので、詳しく見たい方はご自身の教科書をめくってみてください。
近くの官能基の存在によってずれるので、基本的にはざっくりと覚えておけばよいです。
アルキル基の水素は\(1\sim 2\)、ハロゲンや酸素が付いた炭素上の水素原子は\(3\sim 4\)という具合です。
ヒドロキシ基の水素は\(0.5\sim 5\)と幅が極端に広く、化学シフトだけで特定するのは難しいです。
これは、水素結合による速いプロトン交換によって、温度や溶媒、水の存在などが水素原子の電子密度に大きな影響を及ぼすのが原因です。
ヒドロキシ基だけでなく、アミノ基やメルカプト基においても同様の傾向が見られます。
これらのピークの見分け方としては、ピークの幅が広いことが挙げられます。
溶液中で水素周辺の電子密度に分布があることが原因です。
今回の内容はここまでですが、NMRスペクトルの話はもう少し続くので、そちらもまた見ていただけると幸いです。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!