こんにちはー!
それでは今日も化学のお話を見ていきましょう。
今回のテーマはこちらです!
動画はこちら↓
動画で使ったシートはこちら(orientation)
それでは内容に入っていきましょう!
配向性とは
例えば、ベンゼンの一置換体があったとします。
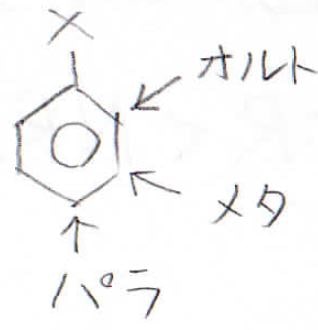
これにもう1個置換基をつけようとしたときに、どこの炭素が置換されやすいかという傾向のことを配向性といいます。
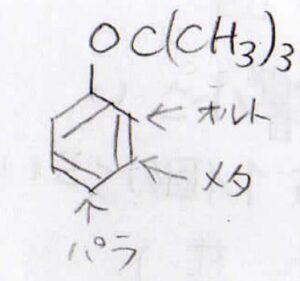
Xと隣接したものはオルト置換体、その隣を置換したものはメタ置換体、正反対の位置を置換したものはパラ置換体と呼びます。
配向性を決定づける要因
ではここから配向性を決定させる要因についてお話ししていきます。
ベンゼンはそもそも結合角ひずみが無くて、共鳴効果もあるという事でとても安定なのですが、π電子が6個もあるので、環の電子密度が大きく、求電子的な化学種と反応することがあります。
そのため、置換基によってベンゼン環中の電子密度が変化すると反応性が変わることになります。
それを引き起こす要因は誘起効果と共鳴効果の2つです。
誘起効果
まず、誘起効果はI効果とも呼ばれ、電気陰性度の差が主な原因となってベンゼン環内の電子密度が変化します。
この効果はσ結合の中で現れるものなので、遠くの結合にはあまり影響がありません。
電子密度を上げてくれる置換基は電子供与基またはドナー基と呼び、電子密度を下げる置換基を電子受容基またはアクセプター基と呼びます。
代表的な電子供与基はアルキル基です。
電気陰性度の差はありませんが、超共役によりベンゼン環内の電子密度が大きくなります。
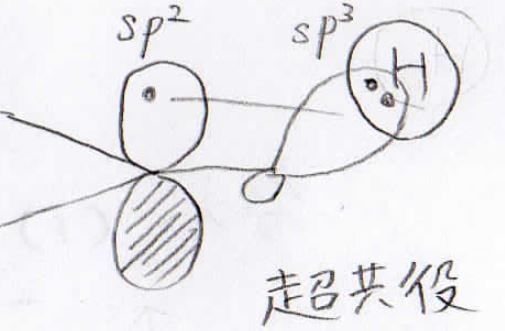
電子求引基は、有機化学で良く出てくる置換基の中ではアルキル基以外と考えて頂いて問題ありません。
ハロゲンやヒドロキシ基、ニトロ基、アミノ基、スルホン基など全部こっちです。
共鳴効果
では続いて、もう一方の要因となる共鳴効果についてお話しします。
これはR効果とも呼ばれ、各共鳴構造に起因しています。
π結合を介しているので、遠くの結合にも関与することができます。
この効果は置換基の原子種というよりは、構造が重要になってきます。
例えば置換基に孤立電子対があった場合、このような共鳴構造を取ることができるので、ベンゼン環内の電子密度が増大することになります。
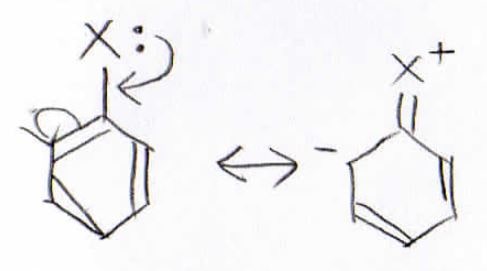
そのため、ハロゲンやアルコキシ基はベンゼン環の電子密度を増大させます。
反対に電子密度を下げる置換基はニトロ基やアシル基になります。
これらは酸素原子に負電荷を抱え込める構造となっているのでこんな共鳴構造を書くことができて、電子密度は小さくなると言えます。
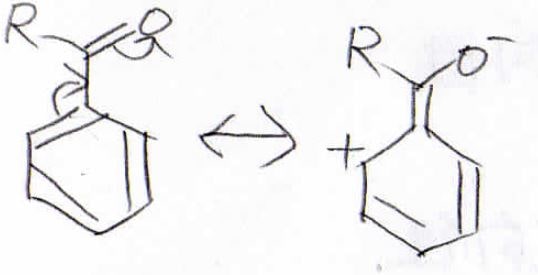
求電子剤とベンゼン置換体の反応
では実際にベンゼンの一置換体に求電子剤を反応させるとどうなるかを考えていきましょう。
誘起効果
電子供与基
まず、置換基がアルキル基だった場合について考えてみると、この置換体はこのような共鳴構造が安定となるのでオルト位とパラ位の電子密度が増大することになります。
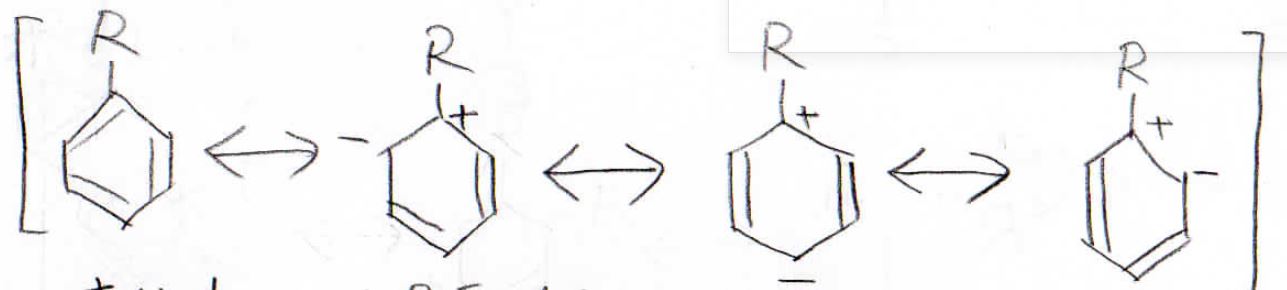
そのため、ここが求電子剤と反応しやすい位置だという事になります。
電子受容基
では続いて置換基がブロモ基だった場合を考えます。
ただし、ブロモ基には孤立電子対があるので共鳴効果もありますが、ここでは誘起効果だけを考えた場合を示します。
ブロモと結合している炭素上に負電荷がある共鳴構造が安定となるので、このような共鳴構造を書くことができます。
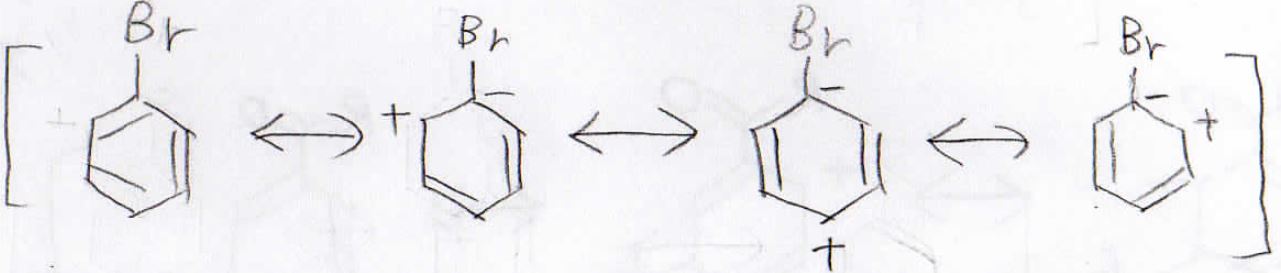
すると、このようにオルト位とパラ位の電子密度が減少し、相対的にメタ位の反応性が上がることになります。
共鳴効果
では続いて、共鳴効果も考えていきます。
孤立電子対を持つ置換基
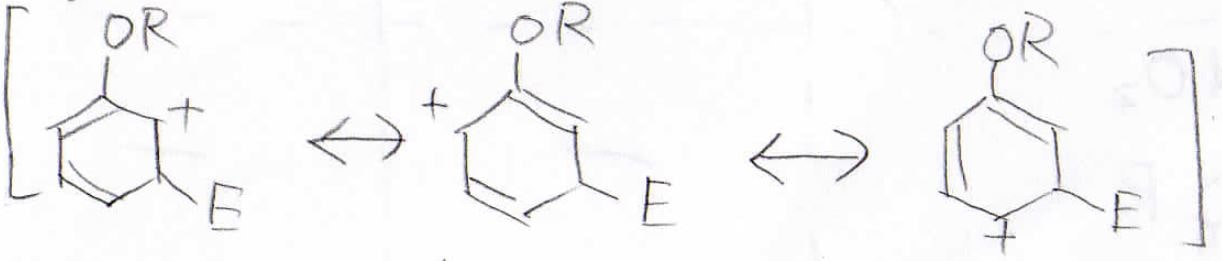
まず始めに置換基をアルコキシ基だったときを考えます。
これはオルト位に求電子剤が付加した際の中間体の共鳴構造ですが、孤立電子対があるため、共鳴構造を4つ書くことができます。
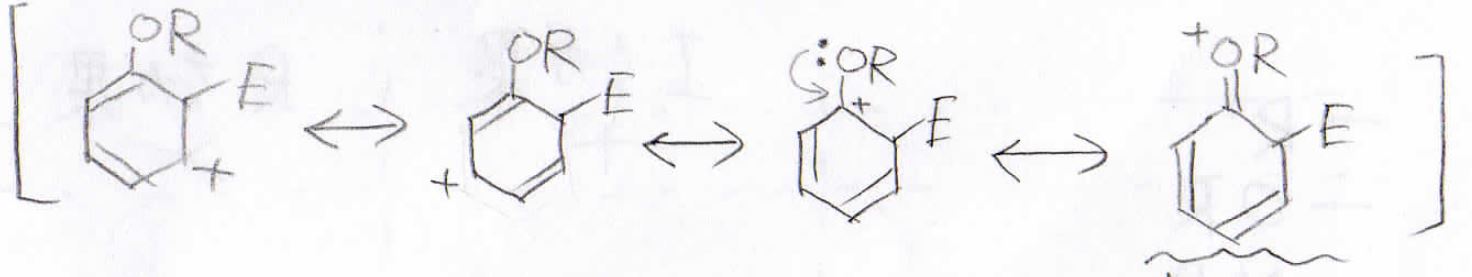
メタ位に付加した場合の共鳴構造は3つだけなので、オルト位に付加した場合のほうが安定な中間体であるという事ができます。
パラ位に付加した場合はオルト位と同様に4つの共鳴構造を書くことができます。
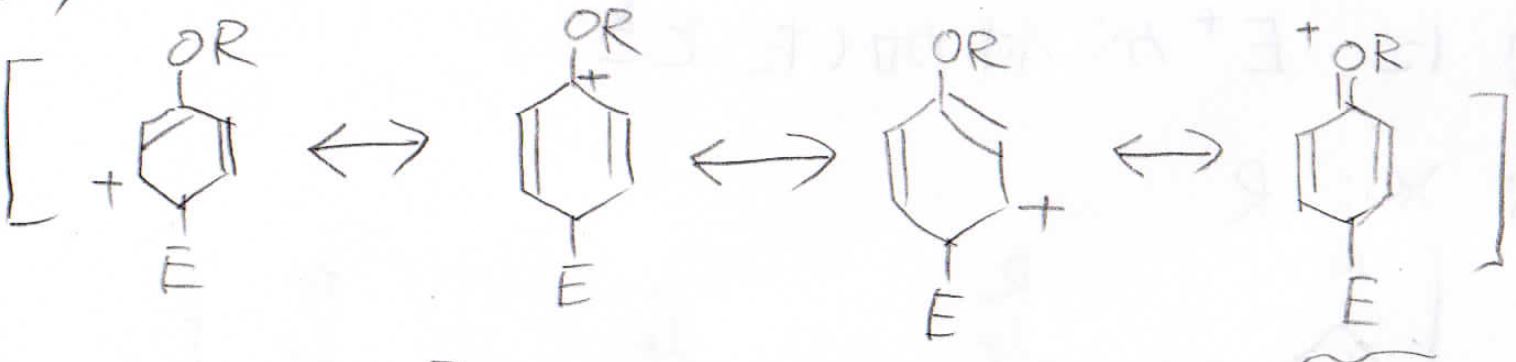
したがって、置換基に孤立電子対があった場合はオルト位かパラ位が置換されやすいということになります。
電子が吸い込める置換基
最後に置換基がアシル基の場合も見てみましょう。
まず、オルト位に付加した場合ですが、酸素原子に電子を受け入れた結果、このような共鳴構造の中間体ができます。
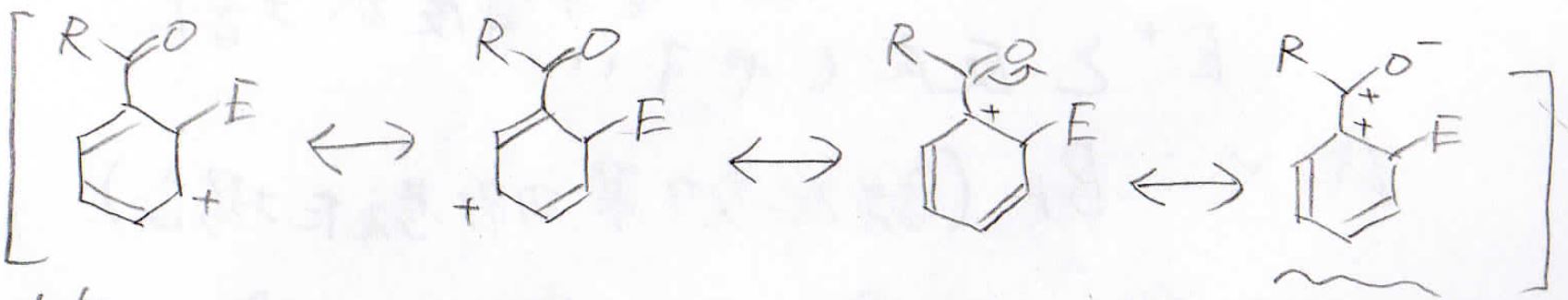
この構造は正電荷が隣接しており、非常に不安定です。
この共鳴構造のおかげで、この中間体が不安定ということになります。
メタ位に付加した場合は、そのような不安定な共鳴構造は見られません。
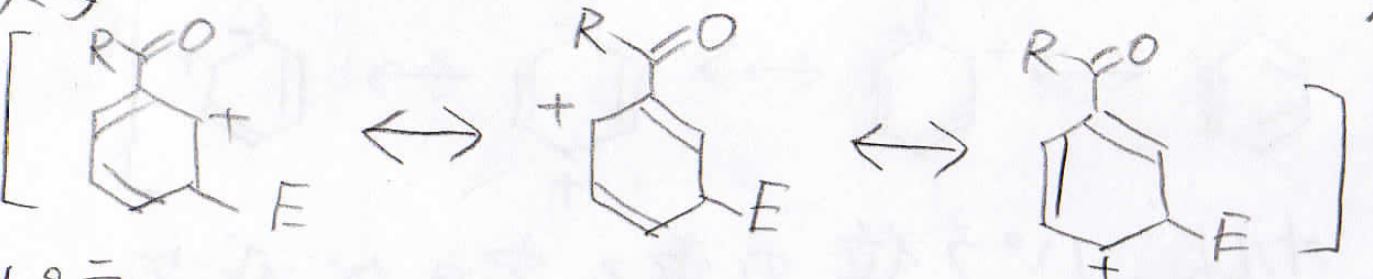
パラ位に付加した場合はオルトと同じように不安定な共鳴構造が表れます。
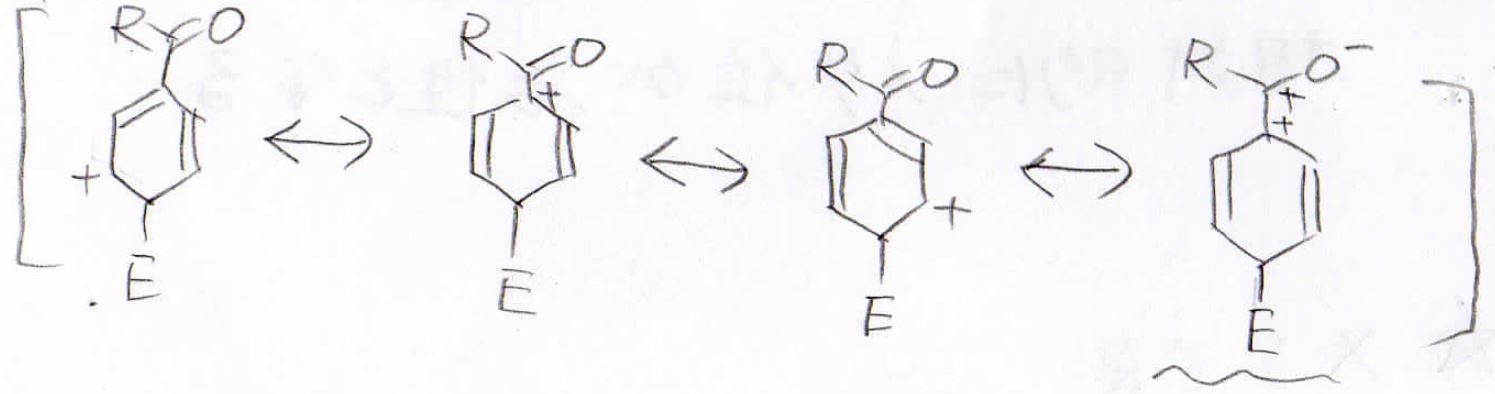
メタ位に付加した中間体が相対的に最も安定になるので、この場合はメタ置換体ができやすいということになります。
各置換基の配向性と活性化度
以上のことをまとめると次の通りになります。
配向性

まず、アルキル基は共鳴効果がないので、誘起効果のみで配向性が決まって、オルト-パラ配向性になります。
酸素原子や窒素原子がベンゼンに結合した構造は誘起効果、共鳴効果いずれも働きますが、この場合は共鳴効果の方が優先されてオルト-パラ配向性になります。
ハロゲンも電気陰性度で考えれば電子求引基ですが、孤立電子対があるので、オルト-パラ配向性になります。
ニトロ基やアシル基では電子を受け入れられる構造があるため、オルト、パラ置換体が相対的にできにくくなり、メタ配向性となります。
ただし、本当にメタ位の反応性が上がったわけではなく、あくまで相対的に反応性が高いという話ですので、反応速度は遅いです。
活性化度
最後にこの求電子置換反応の活性化度について考えます。
これはベンゼン環内の電子密度で決定します。
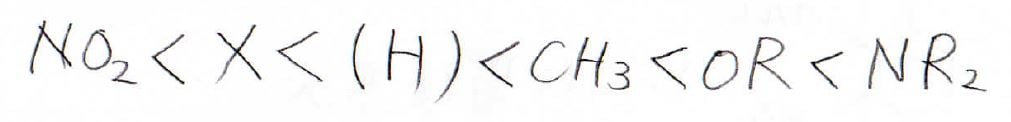
ニトロ基やアシル基はベンゼン環内の電子密度を大きく下げるので、最も反応しにくい部類に入ります。
ハロゲンは配向性こそ共鳴効果で決まりますが、電子密度においては電気陰性度の効果が大きいので、ベンゼン環内の電子密度は減少します。
したがって活性化度で言うとベンゼンのときより下がってしまいます。
アルキル基は共鳴効果がない分、少し活性なぐらいです。
アルコキシ基やアルキルニトロ基では共鳴効果により活性化度が大きく増大します。
アニリンやフェノールでも置換反応は起こりやすいです。
練習問題
それでは恒例の練習問題です。
(1)メトキシ基とスルホン基のパラ置換体に、もう一個置換基をつけようとしたとき、AとBどちらの位置につきやすいか?

それぞれの置換基の配向性から考えてみてください。
(2)tert-ブトキシベンゼンの配向性は?
(1)で、まずはメトキシ基に着目してみましょう。
メトキシ基はオルト-パラ配向性なので、Aのほうが置換されやすいということになります。
同様にスルホン基に着目すると、スルホン基は電子を吸い込める構造を持っているので、メタ配向性になります。
そのため、Aのほうが置換されやすいです。
結局、いずれの置換基から見てもAが置換されやすいということになります。
(2)では、まずtert-ブトキシ基の配向性を考えてみましょう。
するとオルト-パラ配向性なので、メタ置換体ができにくいことがわかります。
ここで、tert-ブトキシ基の嵩高さを考慮すると、オルト位にはなかなか求電子剤が近寄りにくいということが予想されます。
したがって、tert-ブトキシベンゼンはオルト-パラ配向性ですが、オルト置換体よりもパラ置換体のほうができやすいということになります。
まとめ
はい、今回の内容は以上です。
最後におさらいをしておくと、まず配向性とは芳香族化合物の置換がどこの炭素原子上で起こりやすいのかという傾向のことでした。
芳香環内は電子密度が大きいので求電子置換反応が起こります。
そのため、置換基によって電子がどのように偏るのかという事が配向性と活性化度に関与してきます。
電子の偏りを決める要因は2つあって、それは誘起効果と共鳴効果です。
誘起効果は電気陰性度、そして超共役によって、電子が偏る効果です。
代表的な電子供与基はアルキル基で、アルキル基以外のよく見る置換基の多くは、電子受容器となります。
共鳴効果では求電子剤が付加した後の中間体の共鳴構造の寄与を考慮しました。
芳香環に隣接する原子上に孤立電子対がある場合、環内に電子を送り込んだ共鳴構造を書くことができます。
逆に、ニトロ基やアシル基、スルホン基などは酸素原子上に負電荷を抱え込んだ共鳴構造を書くことができるので、環内の電子密度を減少させます。
結局、置換基と配向性は次のようにして決まります。
アルキル基では誘起効果により、オルト-パラ位の電子密度が上昇するのでオルトパラ配向性になります。
ハロゲンやアルコキシ基は誘起効果だけで考えるとメタ配向性ですが、この場合は孤立電子対があるので、共鳴効果が配向性に大きく寄与して、オルト-パラ配向性になります。
この際、アルコキシ基やアルキルニトロ基は共鳴効果により、芳香環内の電子密度が増大しますが、ハロゲンの場合は電気陰性度が大きいため、無置換体のときよりも電子密度が小さくなり、活性も下がります。
ニトロ基やアシル基では誘起効果、共鳴効果いずれにおいても、メタ位の反応性が相対的に高いことになるので、メタ配向性になります。
それでは終わります。
今日もありがとうございました!