こんにちは!
それでは今日も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(isothermal and adiabatic process)
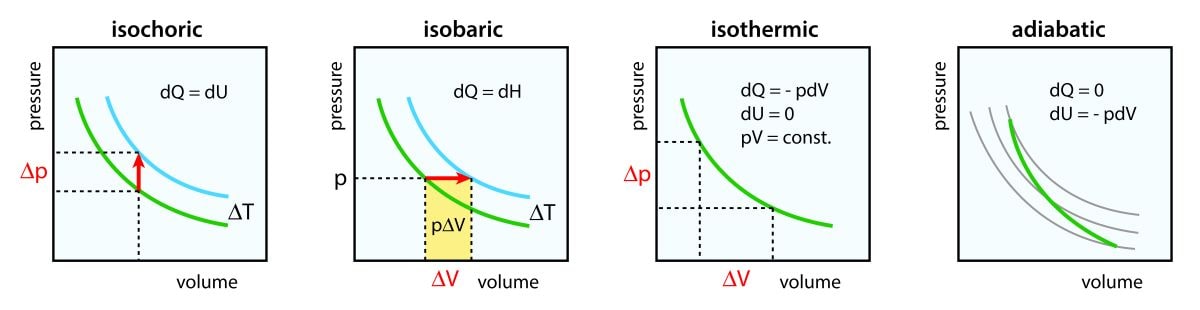
定積変化、定圧変化については、別の記事ですでに話しているので、こちらを参照してください。
それでは内容に入っていきます!
前提
まず今回考える系は、理想気体であるとします。
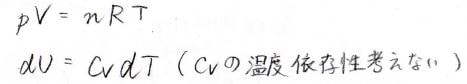
そして、熱容量の温度依存性も、今回はないものとして話を進めていきます。
熱容量の温度依存性については、こちらを参照してください。

等温変化
等温過程では、理想気体の内部エネルギー変化\(\Delta U\)が\(0\)になります。
したがって、熱力学第一法則より、系に与えられた熱量\(q\)と系にされた仕事\(w\)の和は\(\displaystyle 0\)です。
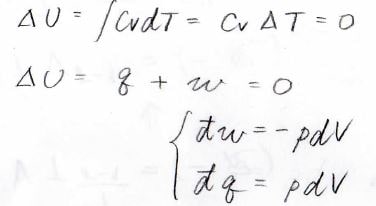
微小量で考えると、\(\rm{d’}\)\(w=-p\rm{d}\)\(V\)となるため、\(\rm{d’}\)\(q=p\rm{d}\)\(V\)となります。
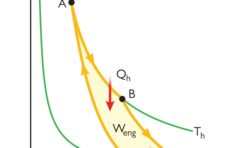
\(p\)-\(V\)グラフ上で等温変化を考えると、下のようになります。
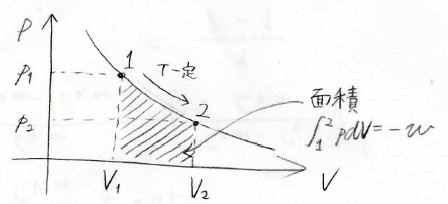
ここでは状態\(1\)から状態\(2\)への等温膨張の例を示しており、系が外部にした仕事\(-w\)は、グラフ上で斜線で示した面積に等しくなります。
圧力\(p\)と体積\(V\)に、それぞれの状態の番号を添え字として付けることにすると、\(w\)は下の式で表されます。
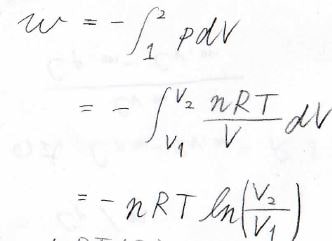
ここで、理想気体の状態方程式より\(\displaystyle p=\frac{nRT}{V}\)であるため、結局\(\displaystyle w=-nRT\ln{(\frac{V_2}{V_1})}\)となります。
また、体積の比をひっくり返すと圧力の比になるため、\(\displaystyle w=nRT\ln{(\frac{p_2}{p_1})}\)と表すこともできます。
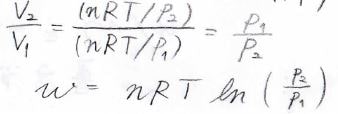
断熱変化
次に、断熱変化を見ていきます。
断熱変化とは、熱の出入りがなく、内部エネルギーの変化量が系に与えられた仕事と等しくなる変化の仕方です。
系が理想気体であることを考えると、これら2つの内部エネルギーの式を合わせることで、体積と温度の関係式が得られます。
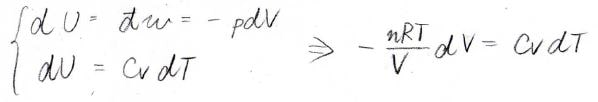
\(p\)-\(V\)グラフで断熱膨張を表すと、下のようになり、必ず温度は減少します。
先ほどの関係式の両辺を状態\(1\)から状態\(2\)まで定積分することを考えると、いま\(C_V\)の温度依存性を無視できるとしているため、定数として積分の外に出せて、下の形になります。
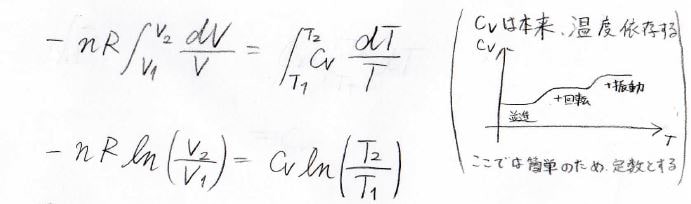
両辺の真数に\(V_2^{nR}T_1^{C_V}\)をかけ、それを\(\displaystyle \frac{1}{nR}\)乗すると、\(VT^\frac{C_V}{nR}\)の値が状態\(1\)と状態\(2\)で変わらないことになります。
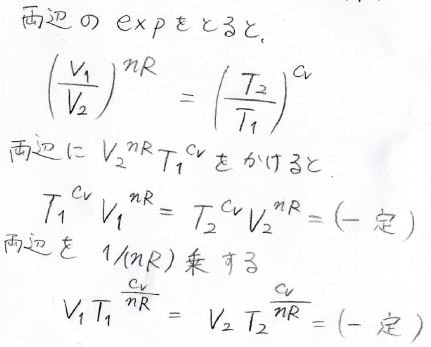
これが、断熱過程における状態量の変化を表す式であり、ここからさらに変形することが可能です。
例えば、\(nR\)はMayerの式より、理想気体の定圧熱容量と定積熱容量の差に等しいので、それぞれのモル熱容量を\(C_{V, \rm{m}}\)、\(C_{p, \rm{m}}\)として表すことにすると、\(T\)の指数は\(\displaystyle \frac{C_{V, \rm{m}}}{C_{p, \rm{m}}-C_{V, \rm{m}}}\)となります。

さらに、\(C_{V, \rm{m}}\)と\(C_{p, \rm{m}}\)の比を\(\gamma\)とすると、先ほどの値は\(\displaystyle \frac{1}{\gamma-1}\)となります。

したがって、\(VT^\frac{1}{\gamma-1}\)は一定であり、これを\(\gamma-1\)乗することで、\(TV^{\gamma-1}\)も一定であることになります。
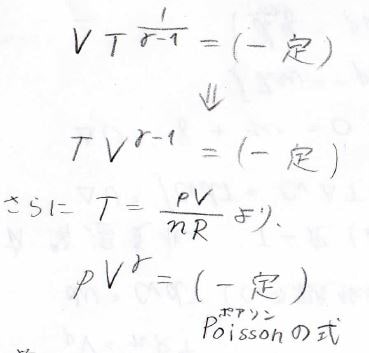
また、理想気体の状態方程式より\(\displaystyle T=\frac{pV}{nR}\)なので、\(pV^\gamma\)も一定になります。
この式は、Poissonの式と呼ばれ、この式だけを知っている方も多いと思います。
最後に、\(\gamma\)がどういった値となるのかを確認しておきますと、これは熱容量の比であり、単原子分子や低温の気体分子では\(1.66\cdots\)となります。
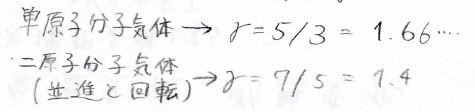
二原子分子で並進と回転が自由度として寄与する場合には、\(1.4\)となります。
Mayerの式および熱容量の温度依存性と自由度の関係については、こちらの記事を参照してください。

まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!