こんにちは!
今回も化学のお話やっていきます。
今回のテーマはこちら!

動画はこちら↓
動画で使ったシートはこちら(thiol sulfide name)
では参りましょう!
アルコールの硫黄類縁体
アルコールの硫黄類縁体のことは、チオールと呼びます。
慣用的にチオアルコールと呼ぶこともあります。
チオールの命名法
IUPACで名前を付けるときは、アルコールだとolをつけてアルカノールとしましたが、チオールの場合はアルカンチオールと呼びます。
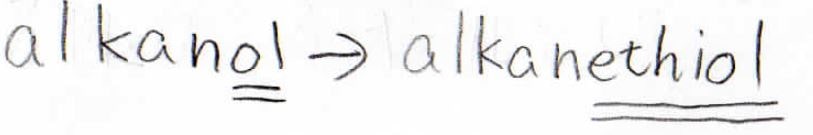
例えば、こちらの左側の化合物は1-プロパンチオール、右側はシクロヘキサンチオールと呼びます。
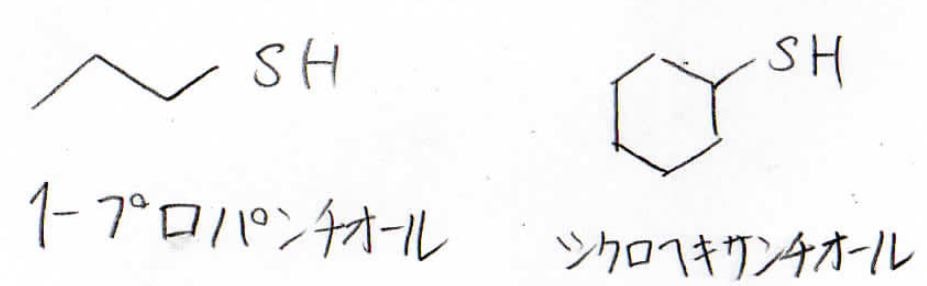
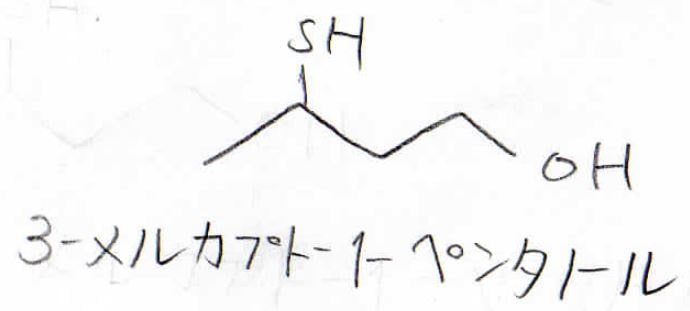
また、1つの分子内に\(\displaystyle \rm{OH}\)基と\(\displaystyle \rm{SH}\)基があった場合は、\(\displaystyle \rm{OH}\)基が優先されてアルコールとして命名します。
\(\displaystyle \rm{SH}\)基はメルカプト基もしくはスルファニル基、スルフヒドリル基と呼びます。
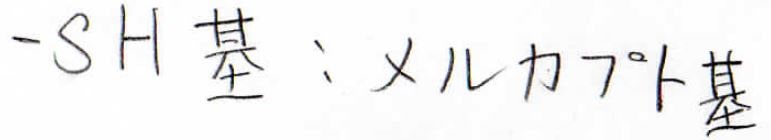
そのため、この化合物は3-メルカプト-1-ペンタノールとなります。
チオールの物性
続いて、このチオールの物性について考えていきましょう。
水素結合性が低い
チオールは水素結合性が低く、アルコールより沸点が低くなります。
水素結合性が低くなるのは、硫黄原子の軌道が広がっていて安定化の効果が小さいことと、硫黄と水素の電気陰性度が近いく電子が偏在しにくいことが原因になっています。

そして、水素結合性が低いことで、アルコールほど液体が安定ではないので、沸点はかなり低くなります。
その値は、むしろハロアルカンに近いと言われています。

酸性度が高い
そして、チオールは、酸性度が高いです。
その原因になっているのは、\(\displaystyle \rm{S-H}\)結合の弱さです。
\(\rm{p}\)\(K_\rm{a}\)は小さいほど酸性度が高いということですが、アルコールが大体\(\displaystyle 15\sim 18\)という値をとるのに対し、チオールの\(\rm{p}\)\(K_\rm{a}\)は\(\displaystyle 9\sim 12\)と顕著な差があることがわかります。
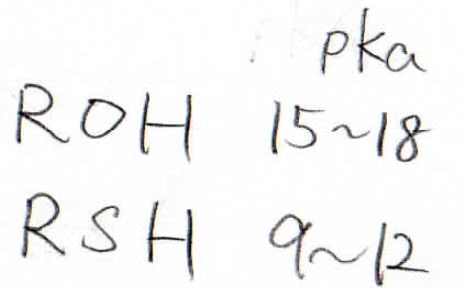
エーテルの硫黄類縁体
次に、エーテルの硫黄類縁体について見ていきましょう。
これはスルフィドまたはチオエーテルと呼ばれます。
スルフィドの命名法
その命名法はまず、慣用名だとスルフィドと言いますが、IUPACの場合はアルキルチオアルカンとして名前を付けます。
\(\displaystyle \rm{RS}\)の部分がアルキルチオ基です。
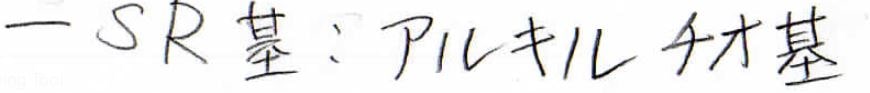
例えば、こちらの左側はIUPAC名でメチルチオエタン、慣用名でメチルエチルスルフィドと言います。
右側は2メチルチオエタノールと呼びます。
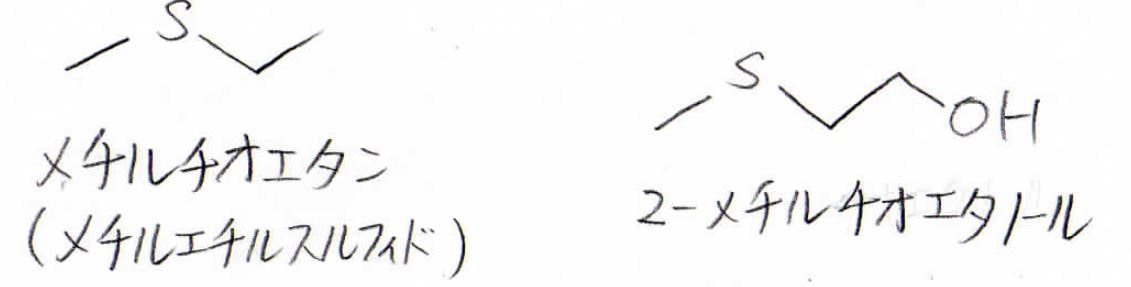
練習問題
最後に、練習問題をやってみましょう。
次に示す3組の化学種で、より酸性度が高いのは、それぞれどちらでしょうか?
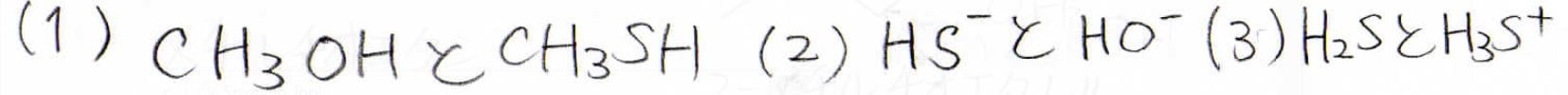
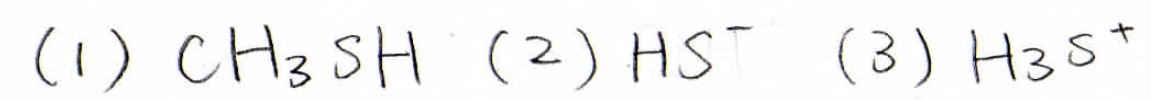
(1)ではメタンチオール、(2)では硫化水素イオン、(3)ではスルホニウムイオンがより強い酸となります。
(1)、(2)は\(\displaystyle \rm{R-H}\)結合の弱さ、(3)は硫化水素が弱塩基であることで共役酸は強塩基になるという、水に対するヒドロニウムイオン\(\displaystyle \rm{H_3O^+}\)と同様の傾向になります。
まとめ
はい、今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!