こんにちは!
今回も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(oxacyclopropane)
では早速行きましょう。
オキサシクロプロパンの反応性
環に含まれる炭素原子は、\(\displaystyle \sigma\)結合が4本あって\(\displaystyle \rm{sp}\)\(^3\)混成軌道なので、安定な結合角は約\(109.5^\circ\)なのですが、実際の環の結合角は約\(60^\circ\)になっています。

ここの部分は、結合を無理にひずませて環状にしてるので、ここに大きな結合角ひずみエネルギーがたまっています。
そのため、この環が解消されたときに、そのエネルギーが放出されることで、大きな安定化の効果が得られます。
そのため、オキサシクロプロパンは反応性に富んだ化学種になります。
優れた求核剤による\(\displaystyle \rm{S_N}\)\(2\)反応
この高い反応性を利用することで、\(\displaystyle \rm{S_N}\)\(2\)反応を起こすことができます。
例えば、オキサシクロプロパンにチオラートを加えると、下のように開環し、アルコキシドになります。
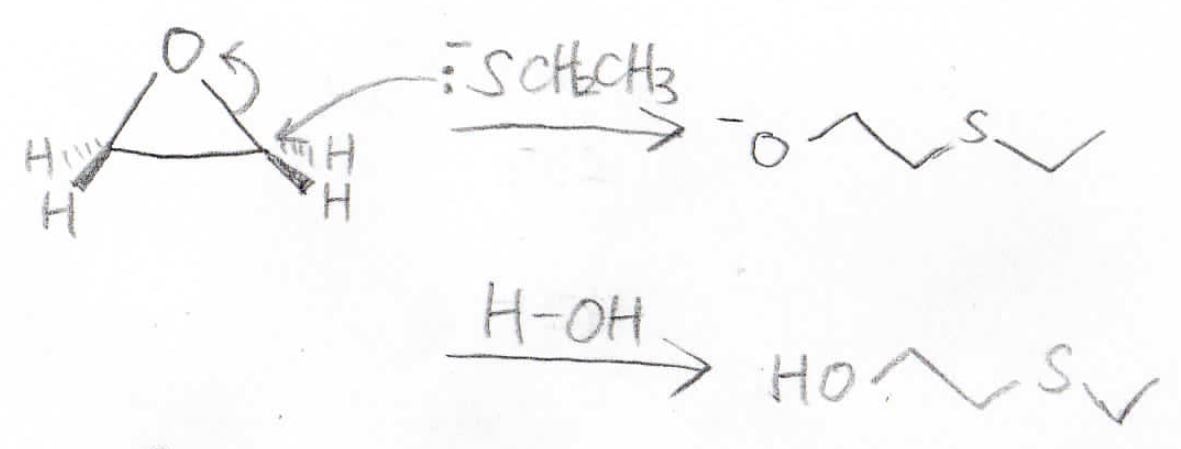
最後は、水からプロトンを引き抜いてアルコールになります。
この反応では、本来脱離能の低いアルコキシドの脱離が起こっています。
これが起こるのは、オキサシクロプロパンの開環により大きな安定化が同時に起こっているからです。
また例えば、下のような非対称エーテルの場合は、より嵩高くない方に求核攻撃が起こります。

この反応を使ってアルコールを作ろうとした場合は、ヒドリド還元剤のリチウムアルミニウムハイドライドを使います。
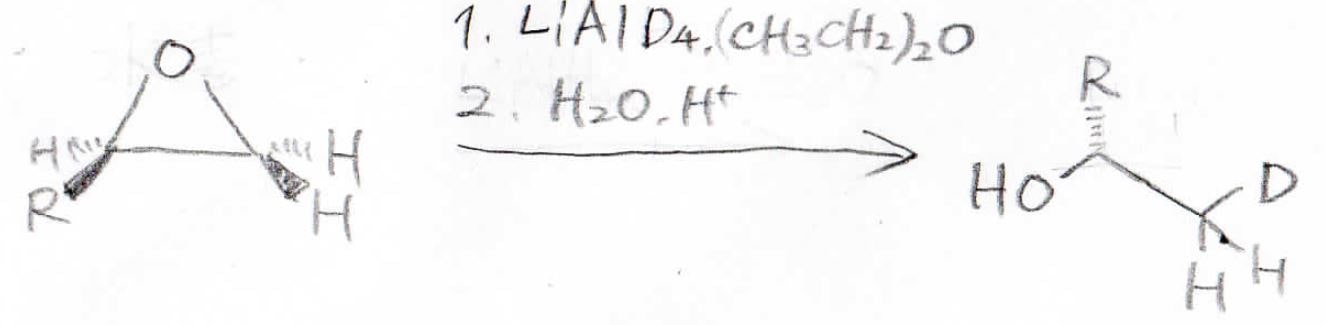
Grinard反応剤を使えば、炭素鎖を長くしたアルコールを作ることもできます。
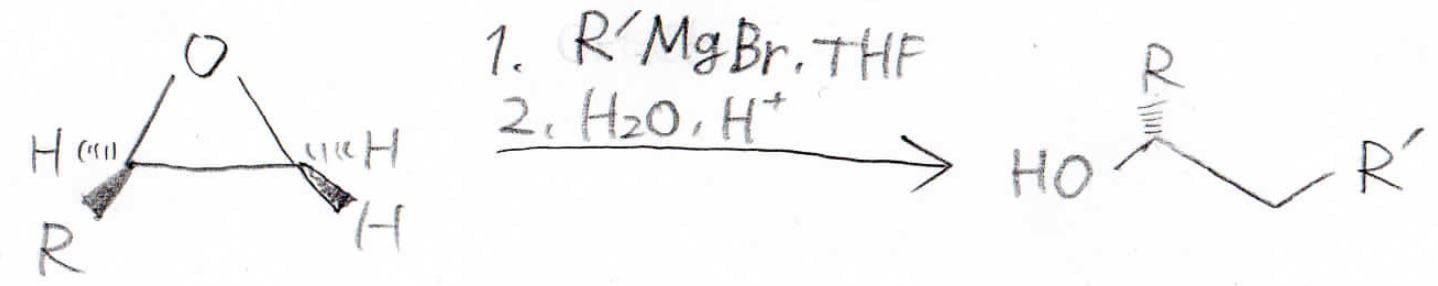
これら反応剤については、こちらの記事で解説しています。

酸触媒での\(\displaystyle \rm{S_N}\)\(2\)反応
ここまでは、優れた求核剤が直接オキサシクロプロパンに攻撃するという反応を見てきたのですが、実は、酸性条件下で求核性の小さなアルコールなどを反応させることもできます。
下図の反応がその一例ですが、ここで注目してほしいのが、求核置換が起こる炭素原子はより嵩高い方になっているということです。
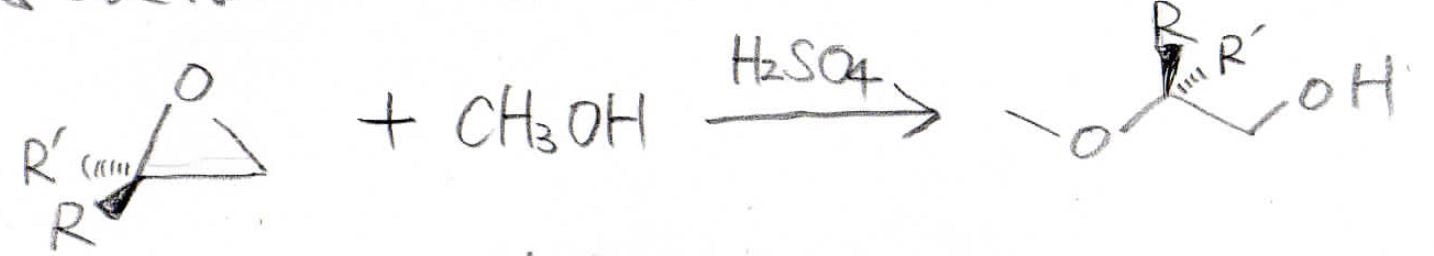
これはなぜなのか、反応機構を見てみると、まず酸素原子上の孤立電子対でプロトンを受け取って、このカチオンの嵩高い方へアルコールが近づいてきます。

アルキル基は電子供与性で、カルボカチオンの安定性を超共役により高めるということがありますが、ここでも似たようなことが起こっています。
環の正電荷がどちらの炭素原子に偏りやすいか実際に書いて比べてみると、左側、つまり第三級炭素上に正電荷があったほうが、安定なカルボカチオンに近い構造をとれるので、安定となります。

したがって、アルコールはより求電子的な第三級炭素を攻撃することになります。
アルコールは本来\(\displaystyle \rm{S_N}\)\(2\)反応を起こしませんが、この場合は求核攻撃と開環が同時に起こるので、立体特異的な反応となります。
練習問題
最後に、練習問題です。
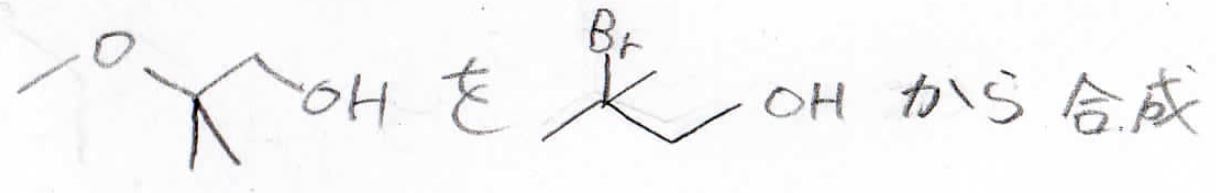
2-メトキシ-2-メチル-1-プロパノールを2-ブロモ-2-メチル-1-プロパノールから合成するにはどうしたら良いでしょうか?
別解はこちらの記事の中にあります。

まず、生成物から逆算していくのですが、メトキシ基を第三級炭素につけるために酸触媒でメタノールによる開環反応を考えます。
この三員環は、ハロアルコールに強塩基を加えた分子内Williamsonエーテル合成によってできます。
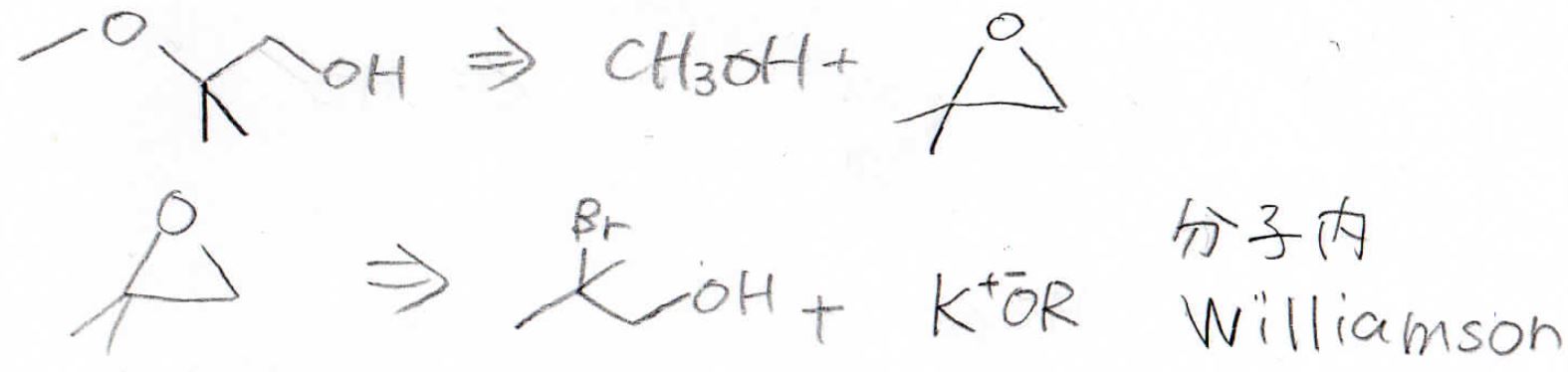
Williamsonエーテル合成法についてはこちらをご覧ください。

最後、これをひっくり返して、以下のように合成戦略を立てることができます。

まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!




