こんにちは!
それでは今回も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(IR)
それでは内容に入っていきます!
赤外分光法で、何が見えるのか?
始めに、今回のテーマである赤外分光法の説明をします。
赤外は英語でinfraredというため、IRと呼ばれることが多いです。
この測定では、化合物に赤外線を当てて、透過してきた赤外線の強度を測定します。
もし分子がある特定の波長の赤外線を吸収した場合は、透過率が下がるため、実験的にそれを確認できます。
そもそも赤外線というのは、波長が\(700\sim 1000\ \rm{nm}\)程度の電磁波を指します。
中でも\(2.5\sim 16.7\ \rm{nm}\)の中赤外線が、有機化合物の同定にはよく利用されます。
このとき、光子\(1\ \rm{mol}\)あたりのエネルギーは\(4\sim 42\ \rm{kJ}\)になります。
この値は、分子の振動準位のエネルギー差に相当しており、IRは分子の振動励起を見る方法だということになります。
ただし、振動の遷移とともに回転準位で遷移が起こった場合には、回転のモードも一緒に見えるため、振動だけを見る方法ではないということも合わせて覚えておいてください。
詳しくは、こちらを参照してください。

通常、IR測定では、光子のエネルギーが光の波長の逆数に比較するという関係から、波長の逆数をエネルギー単位として扱います。
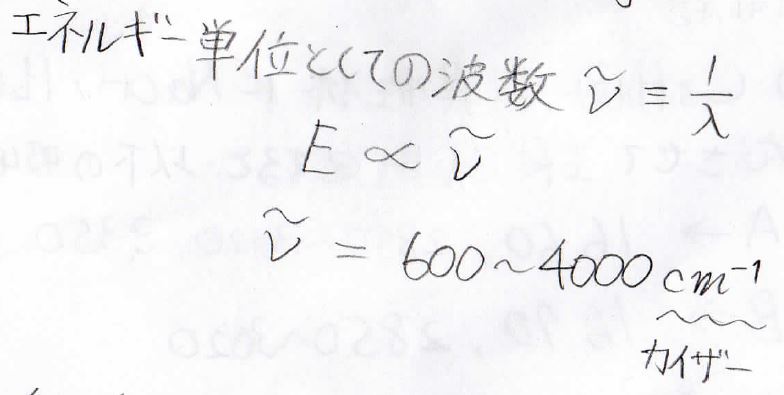
波長の逆数は波数と呼ばれ、単位には\(\rm{cm}^{-1}\)を使います。
この単位は慣例的、便宜的にカイザー(\(\rm{K}\))と呼ばれることがありますが、近年はこの呼び方をするべきではないとされています。
上のエネルギーを波数単位で表すと\(600\sim 4000\ \rm{cm}^{-1}\)になります。
振動励起とIRスペクトル
続いて、振動励起とIRスペクトルの関係についてお話します。
ここでは、ばね定数\(k\)のバネで繋がれた2つの物体の運動を考えることにします。

換算質量を使うと、二体問題を単体問題にすることができ、計算が容易になります。
詳しくは、こちらの記事をご覧ください。

調和振動子の振動準位をシュレディンガー方程式によって求めると、量子数を\(n\)として\(\displaystyle (n+\frac{1}{2})\hbar\omega\)となります。
ここで、\(\hbar\)はプランク定数を\(2\pi\)で割ったディラック定数、\(\omega\)は角周波数で\(\displaystyle \sqrt{\frac{k}{\mu}}\)です。
詳しくは、こちらの記事で解説しています。

吸収される電磁波のエネルギーは、振動準位間のエネルギー差であり、振動準位の間隔は一定で\(\hbar\omega\)になります。
これが光子のエネルギー\(hc\tilde{\nu}\)と等しくなることから、波数\(\tilde{\nu}\)は\(\displaystyle \frac{1}{2\pi c}\sqrt{k\frac{m_1+m_2}{m_1m_2}}\)になります。
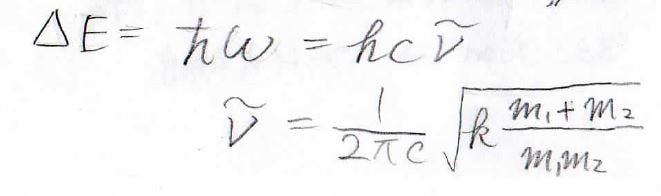
すなわち、吸収される波の波数は、結合の強さと結合を形成する原子の質量に依存するということになります。
分子の振動モードの種類
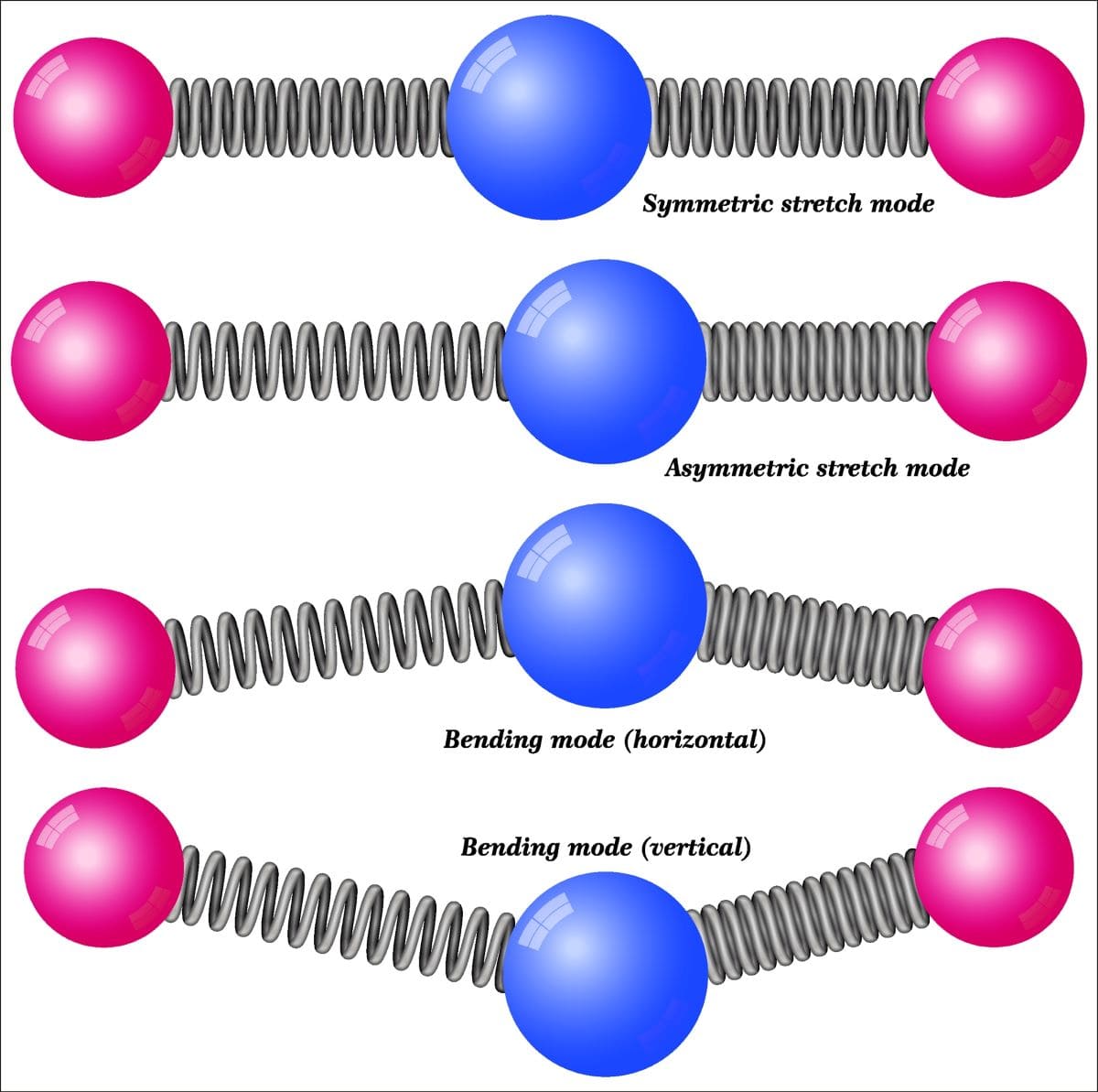
次に、分子の振動が実際にどのように動いているのかを考えてみます。
1本の結合については、伸び縮みするだけですが、2本の結合で結ばれた3原子の振動には、これだけの種類があります。
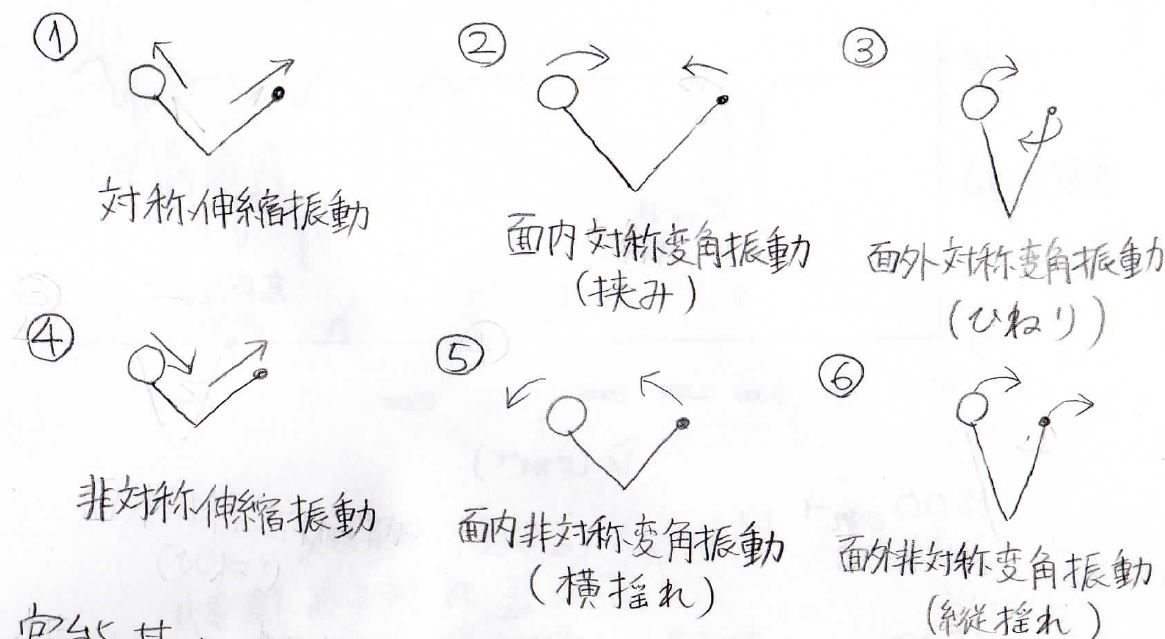
①は両方の結合が同時に伸びて同時に縮む対称伸縮振動、②は同一面内で結合角が狭くなったり広がったりを繰り返す対称面内変角振動、通称挟み振動、③は三原子を結ぶ平面が動きながらねじれるように振動する対称面外変角振動、通称ひねり振動、そして④、⑤、⑥はそれらが逆対称となったものです。
⑤は横揺れ振動、⑥は縦揺れ振動とも言います。
このように、1つの構造についていくつもの吸収ピークが考えられるため、スペクトルが複雑になるというのが、IRの特徴になります。
官能基に見られる特徴的な吸収ピーク
それぞれのモードに対応した吸収波数は、厳密には、分子を構成するすべての原子種に依存します。
しかし、吸収波数の大まかな値は、振動している結合を構成している原子種から予想することができるため、官能基の存在を調べることに利用されます。
各種官能基の伸縮振動に対応する波数の実際の値は、こちらの表のとおりです。

詳細は、後ほど説明しますが、基本的なことだけお話しします。
まず、ヒドロキシ基の\(\displaystyle \rm{O-H}\)伸縮は、\(3400\ \rm{cm}^{-1}\)周辺に幅の広いピークとして見えます。
水素結合のでき方はランダムで一様ではないため、\(\rm{O}-\rm{H}\)間距離にも分布が生じるため、ピークの幅が大きくなっています。
\(\rm{C}\)\(-\rm{H}\)結合の伸縮についても、その炭素が\(\rm{sp}\)\(^2\)混成なのか\(\rm{sp}\)\(^3\)混成なのかによって、吸収波数が異なります。
これにより\(3000\ \rm{cm}^{-1}\)を超えているのがアルケン、\(3000\ \rm{cm}^{-1}\)を超えていないのがアルカンと判別することができます。
最後に、ここでは詳しくやりませんが、アルデヒド、ケトン、エステルなどに存在するカルボニル、すなわち\(\rm{C}\)\(=\rm{O}\)結合の伸縮は、いずれも\(1700\ \rm{cm}^{-1}\)付近にピークを示します。
それがケトンなのか、エステルなのか、アミドなのかという違いによって、\(\displaystyle 50\ \rm{cm}\)\(^{-1}\)ほどの違いが生じます。
そして、\(\rm{C}\)\(=\rm{C}\)結合の伸縮は\(1700\ \rm{cm}^{-1}\)より少し小さいくらい、\(\rm{C}\)\(-\rm{O}\)結合は\(1000\sim 1260\ \rm{cm}^{-1}\)という値になり、他の構造の変角振動もここら辺にくると、かなり見えにくい部分になります。
IRスペクトルの例
ここからは、実際のIRスペクトルをもとにお話ししていきます。
IRスペクトルは、横軸を光の波数、縦軸を光の透過率として書かれます。
ただし、横軸は波数が大きいほど左側になるように書かれているので、そこに注意してください。
吸収があった場合には、グラフ上で谷の形として現れます。
n-ペンタン
1つ目に紹介するのは、n-ペンタンのスペクトルです。
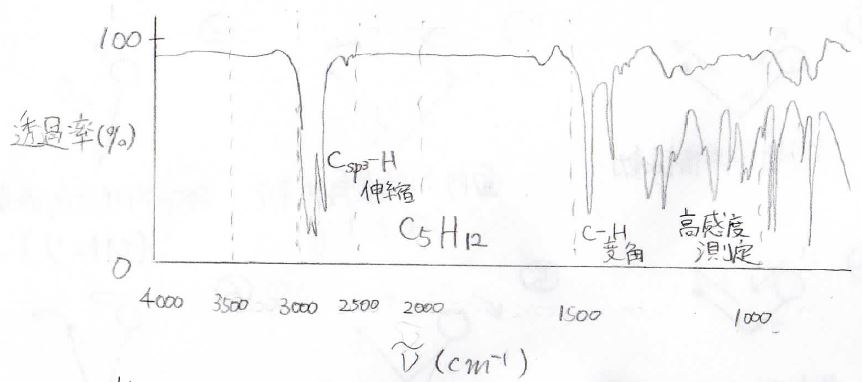
特徴的なピークは、\(\rm{sp}\)\(^3\)炭素と水素の結合の伸縮振動で、\(3000\ \rm{cm}^{-1}\)より少し小さいところに出てきます。
このように官能基の伸縮振動がわかりやすく出てくる領域は診断領域と呼ばれ、\(1500\ \rm{cm}^{-1}\)以上が該当します。
しかし診断領域だけでは、それがアルカンであることしかわからず、炭素数や分岐の有無などは判別できません。
そこで、\(1500\ \rm{cm}^{-1}\)未満の領域を見ます。
ここでは、一部の伸縮振動と変角振動が相まって非常に複雑なスペクトルを示します。
そのパターンには、炭素数や分岐の有無も反映されているため、化合物の同定に役立てられるということになります。
化合物に固有の複雑なパターンという意味で、この領域は指紋領域と呼ばれます。
1-ヘキセン
続いて、1-ヘキセンのスペクトルを見ていきましょう。
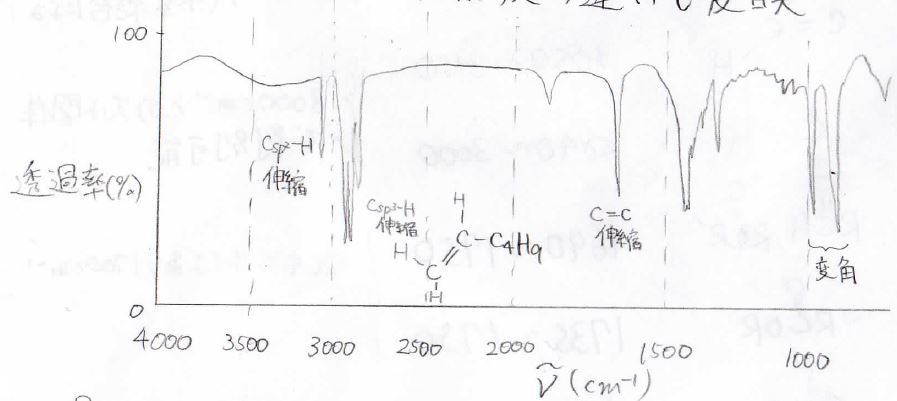
先ほどと同じように、\(3000\ \rm{cm}^{-1}\)より少し小さいところで\(\rm{sp}\)\(^3\)炭素と水素の伸縮振動が観測されるほか、\(3000\ \rm{cm}^{-1}\)より少し大きいところに\(\displaystyle \rm{sp}\)\(^2\)炭素と水素の伸縮振動が見えるようになります。
そして、\(1650\ \rm{cm}^{-1}\)あたりに\(\displaystyle \rm{C=C}\)結合の伸縮振動が観測されます。
指紋領域には、置換アルケンの構造を反映した面外変角振動が\(900\sim 1000\ \rm{cm}^{-1}\)付近に見られます。
具体的には、一置換アルケンで\(915\)と\(995\ \rm{cm}^{-1}\)、1,1-二置換アルケンで\(890\ \rm{cm}^{-1}\)、トランス-二置換アルケンで\(970\ \rm{cm}^{-1}\)に特徴的なピークが現れることになります。
シクロヘキサノール
最後に、シクロヘキサノールのスペクトルを見てみましょう。
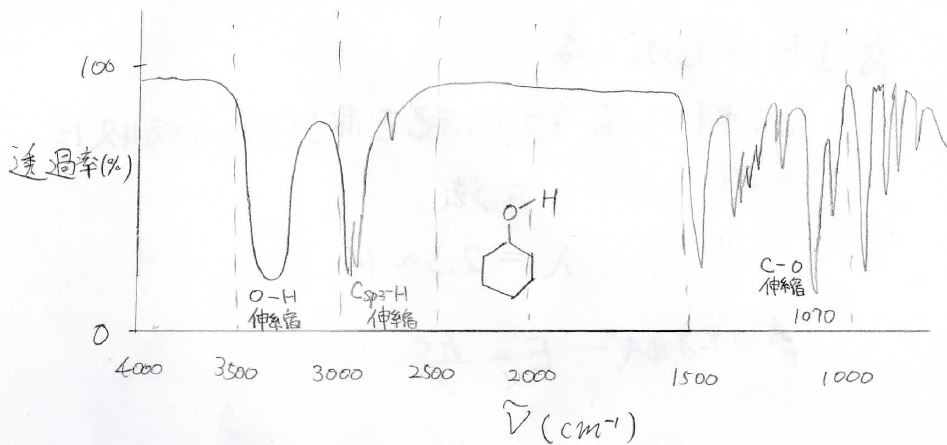
\(3400\ \rm{cm}^{-1}\)付近にブロードなピークが見られることから、ヒドロキシ基をもつということがわかります。
そして、\(\rm{sp}\)\(^3\)炭素と水素の伸縮振動が\(3000\ \rm{cm}^{-1}\)より少し小さいところに出てきます。
\(\rm{C}\)\(-\rm{O}\)伸縮は指紋領域なのでわかりにくいですが、\(1070\ \rm{cm}^{-1}\)に観測されます。
このスペクトルを目視しただけだと、シクロヘキサノールだと断定できませんが、元素分析やNMRなどを組み合わせたり、指紋領域をよく調べたりすることで、同定ができます。
練習問題
それでは、練習問題をやってみましょう!
\(\displaystyle \rm{C_5H_{11}Br}\)という分子式をもつ、2種類の化合物\(\rm{A}\)と\(\rm{B}\)のそれぞれに\(\rm{NaOH}\)、\(\rm{H_2O}\)、\(\rm{C_2H_5OH}\)を反応させた後に、IRを測定したところ、次のようなスペクトルが得られました。
\(\rm{A}\)では\(1660 \rm{cm}^{-1}\)と\(2850\sim 3020\ \rm{cm}^{-1}\)と\(3350\ \rm{cm}^{-1}\)、\(\rm{B}\)では\(1670\ \rm{cm}^{-1}\)と\(2850\sim 3020\ \rm{cm}^{-1}\)に吸収が見られました。
このとき、反応が起こる前の化合物\(\rm{A}\)、\(\rm{B}\)に考えられる構造をすべて答えてください。
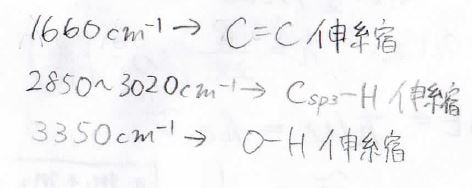
\(\displaystyle \rm{A}\)と\(\displaystyle \rm{B}\)の違いは、\(3350\ \rm{cm}^{-1}\)にピークがあるかどうか、つまりはアルコールが生成するかどうかが異なるということです。
そして、両者ともに見られた\(1660\ \rm{cm}^{-1}\)のピークは、アルケンに特徴的なものですので、\(\rm{A}\)ではアルケンとアルコールの混合物ができて、\(\rm{B}\)ではほとんどアルケンしかできなかったということになります。
あとは、ハロアルカンの求核置換反応と脱離反応がどういう条件で起こりやすいのかを考えることで、答えが推測できます。
詳しくは、こちらをご参照ください。

答えは、\(\rm{A}\)が第二級ブロモアルカンである下の3種類、\(\rm{B}\)が第三級ブロモアルカンとなる2-ブロモ-2-メチルブタンになります。
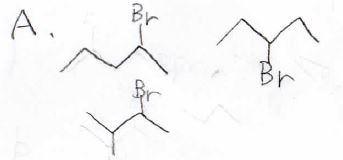
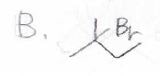
ちなみに、これはある教科書からとってきた問題と答えですが、\(\rm{A}\)については分岐構造をもつ第一級ブロモアルカンを書いても、不正解にはならないと思います。
まとめ
はい、今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!