こんにちは!
それでは今日も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(ligand field splitting)
金属錯体とは
中心原子に配位子が配位することでできる化合物を錯体と呼び、特にその中心原子が金属であるものは金属錯体と呼ばれます。
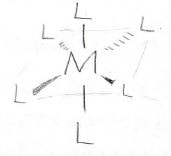
ここで、\(\displaystyle \rm{L}\)は配位子を指すLigandの頭文字です。
そして、一方の原子が電子対を供与することで形成される結合のことを配位結合と言います。
電子を1個ずつ出し合う共有結合と区別されていますが、本質的にはほとんど変わりません。
配位子には種類があり、配位できる部分がいくつあるかで1座配位子、2座配位子という呼び方をします。
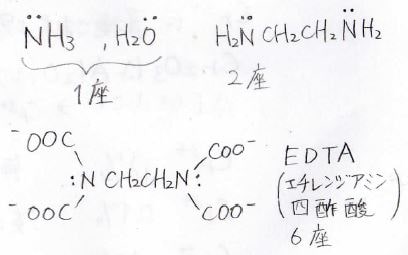
6座配位子もあって、有名なものがエチレンジアミン四酢酸、通称EDTAです。
これは、金属イオンの濃度を決めるための滴定に使われる試薬です。
そのほか、金属錯体がほかの金属に配位するパターンもあります。
錯体の立体構造
では続いて、錯体の立体構造を見ていきましょう。
ここでは主要な2つについて紹介します。
八面体6配位
1つ目は八面体6配位です。
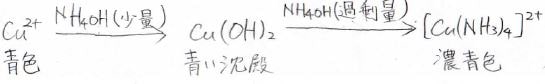
高校でも習うテトラアンミン銅(II)イオンがこれにあたります。
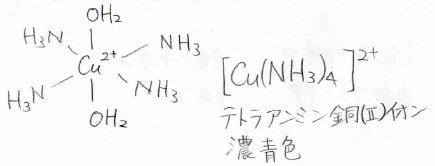
錯体であり、さらに全体で電荷が打ち消されていないものは、錯イオンと呼びます。
平面上にアンモニアが位置して、その平面に垂直な方向に水分子が配位します。
高校でも習ったとおり、これはきれいな濃青色を呈します。
四面体4配位
続いて紹介するのは、テトラアンミン亜鉛(II)イオンに代表される四面体4配位です。
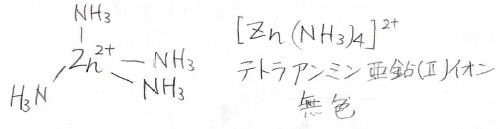
高校でも習うとおり、これは無色のイオンです。
\(\displaystyle \rm{d}\)軌道の分裂
それでは今回のメインテーマに移っていきます。
これら金属錯体には無色のものもありますが、きれいな色を呈するものがたくさんあります。
色がついて見えるということは可視光を吸収しているのですが、その吸収に大きく関わっているのが中心金属の\(\displaystyle \rm{d}\)軌道です。
色が見える原理については、こちらの記事を参照ください。

配位子によって供与された電子が中心原子の\(\displaystyle \rm{d}\)軌道を占有したときに、ある現象が起こります。
ここで、まずは原子の\(\displaystyle \rm{d}\)軌道の形を改めて確認しておきましょう。
詳しくは、こちらの記事の終わりの方にも書いています。
\(\displaystyle \rm{d}\)軌道とは、角運動量量子数(または方位量子数)が\(\displaystyle 2\)で、磁気量子数が\(\displaystyle 0\)、\(\displaystyle \pm 1\)、\(\displaystyle \pm 2\)をとる軌道のことで、水素様原子では、5つの軌道がすべて同じエネルギーをもっています。
それぞれの軌道の形は、下記のとおりです。
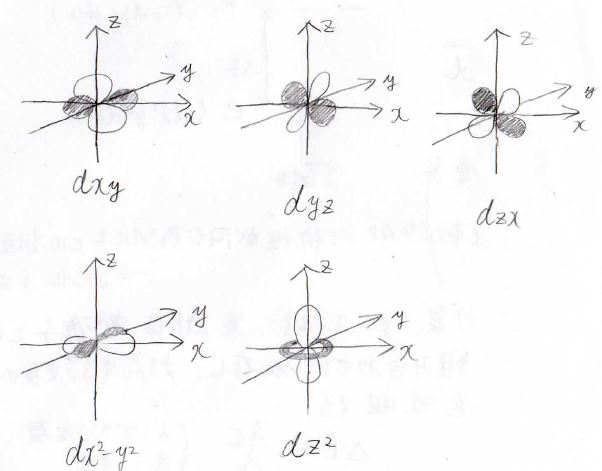
これらをよく見てみると、座標軸方向に向いているものと、座標軸から\(\displaystyle 45^\circ\)傾いた方向に向いているものがあります。
具体的には、\(\displaystyle \rm{d}\)\(_{x^2-y^2}\)と\(\displaystyle \rm{d}\)\(_{z^2}\)軌道が座標軸方向、それ以外が座標軸から傾いた方向を向いています。
八面体6配位では、配位子が座標軸上にあるため、軌道の方向によって反発の度合いが変わります。
四面体4配位でも、同様に座標軸上にあるかどうかで配位子の電子から受ける反発が変わります。
その結果、静電反発を最小にして安定な構造となるために、縮退していた\(\displaystyle \rm{d}\)軌道が異なるエネルギー状態へ分裂します。
配位子によって分裂の大きさが変わるとした考え方は配位子場理論と呼ばれ、これによって起こる軌道の分裂を配位子場分裂と言います。
軌道の対称性と相互作用についてはこちらも参照ください。

分裂のしかたは、錯体の立体構造に依存します。
八面体6配位の場合は、低エネルギー側に\(\displaystyle \rm{d}\)\(_{xy}\)、\(\displaystyle \rm{d}\)\(_{yz}\)、\(\displaystyle \rm{d}\)\(_{zx}\)軌道の3つ、高エネルギー側に\(\displaystyle \rm{d}\)\(_{x^2-y^2}\)、\(\displaystyle \rm{d}\)\(_{z^2}\)軌道の2つがきます。
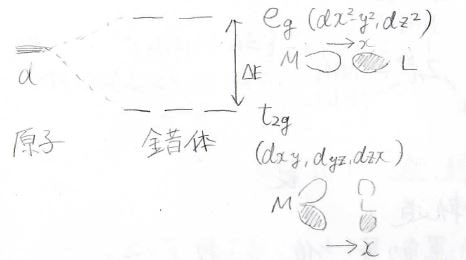
座標軸上に配位子があることを考えると、安定なほうの軌道では\(\displaystyle \pi\)結合性的な安定化、不安定なほうの結合では\(\displaystyle \sigma\)反結合性的な不安定化が起こっていることになります。
四面体4配位の場合は、安定なほうに\(\displaystyle \rm{d}\)\(_{x^2}\)、\(\displaystyle \rm{d}\)\(_{z^2}\)軌道の2つ、不安定なほうに\(\displaystyle \rm{d}\)\(_{xy}\)、\(\displaystyle \rm{d}\)\(_{yz}\)、\(\displaystyle \rm{d}\)\(_{zx}\)軌道の3つという形に分裂します。

分裂した後のエネルギー差\(\Delta E\)は、配位子と金属元素の組み合わせによって決まります。
そして、そのエネルギー差に相当する電磁波の波長が可視光領域にあった場合には、色がついて見えるようになるというわけです。
吸収波長は、この式で決まります。
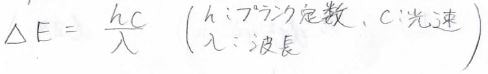
ルビーとサファイアの色の正体
では最後、宝石の色について小話を1つして終わろうと思います。
まったく違う見た目の宝石ですが、実は、ルビーとサファイアはコランダムという同じ名前の石です。
コランダムとは酸化アルミニウム、すなわちアルミナ結晶を主骨格とする鉱物のことです。
アルミナ結晶にはいくつか異なる形がありますが、その1つは下のようなものです。
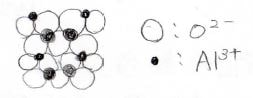
コランダムはもともと透明な石なのですが、\(\displaystyle \rm{Al}\)\(^{3+}\)がしばしば他の金属イオンに置換されて、その金属の種類と割合に応じて色が付きます。
その中で赤色のものをルビーと呼び、青色のものがサファイアになります。
ただし、このサファイアは狭義でのサファイアであり、広義でのサファイアは赤色以外の色をもつコランダムすべてを指します。
ときには、透明なコランダムも無色サファイアと呼ぶことがあります。
では実際に、不純物の量と色の関係を見ていきましょう。
ここでは、不純物としてクロム(III)イオン\(\displaystyle \rm{Cr}\)\(^{3+}\)を含む場合を考えてみましょう。
\(\displaystyle \rm{Cr_2O_3}\)は\(\displaystyle \rm{Al_2O_3}\)よりも結合距離が長いため、\(\displaystyle \rm{Cr}\)\(^{3+}\)が多くなるほど、\(\Delta E\)が小さくなり、吸収波長は長くなっていきます。

純粋なコランダムである無色サファイアからクロムの濃度を上げていくと、\(\displaystyle 0.1\%\)が置換されたところで淡い赤色になります。
これがピンクサファイアです。
そして、クロムが\(\displaystyle 1\%\)になると鮮やかな赤色のルビーになります。
さらに増やした場合には赤に近い色の光を吸収することで、緑っぽい色のグリーンサファイアになります。
もっとクロムを増やしていくと、やがて赤外線および可視光をいくつも吸収するようになります。
こうなると、色の鮮やかさは失われて、黒っぽい色に近づいていき、宝石としての価値も失われてしまいます。
この石は、エメリーと呼ばれます。
クロム以外でも、鉄とチタンを含むものに青色のサファイアがあります。
鉄のみを含む場合には黄色になって、これはイエローサファイアと呼ばれます。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!