こんにちは!
今回も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(thiol sulfide reaction)
チオール、スルフィドの命名法と物性については、こちらの記事をご覧ください。

チオールの合成法
まず、チオールは硫化水素イオンをハロアルカンに求核攻撃させることで得られます。

ただし、硫化水素イオンを過剰量加える必要があります。
もし等量を反応させた場合は、生成物がさらに反応を起こしてしまう可能性があるためです。
生成したチオールは酸解離して\(\displaystyle \rm{RS}\)\(^-\)、つまりチオラートになって、これはアルコキシドより優れた求核剤であるので、\(\displaystyle \rm{S_N}\)\(2\)反応が起こってしまいます。

硫化水素イオンが過剰量あれば、チオラートとハロアルカンが出会う可能性が小さいので、チオールを多く得られることになります。
スルフィドの合成法
スルフィドはチオールとハロアルカンに水酸化ナトリウムなどの強塩基を加えることで合成できます。
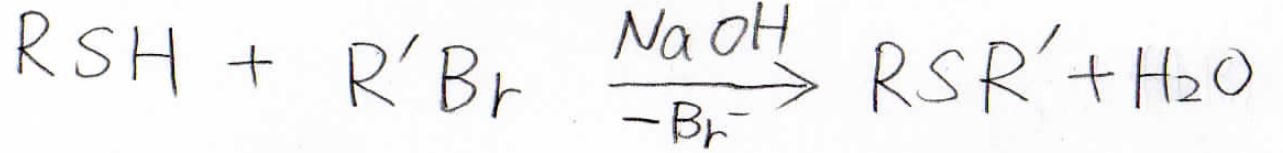
この反応は、エーテルのWilliamson合成法とまったく同じ形です。
Williamsonエーテル合成法についてはこちらをご覧ください。

チオラートは弱い塩基なので、脱離の副反応はほとんど起こらず、\(\displaystyle \rm{S_N}\)\(2\)反応がきれいに進行します。
水酸化物イオンの求核攻撃との競合もほとんどなくスルフィドだけが生成します。
求核剤、脱離基としてのスルフィド
続いて、スルフィドは分子全体で電気的に中性でありながら、そこそこ強い求核剤としてもふるまうので、それを紹介します。
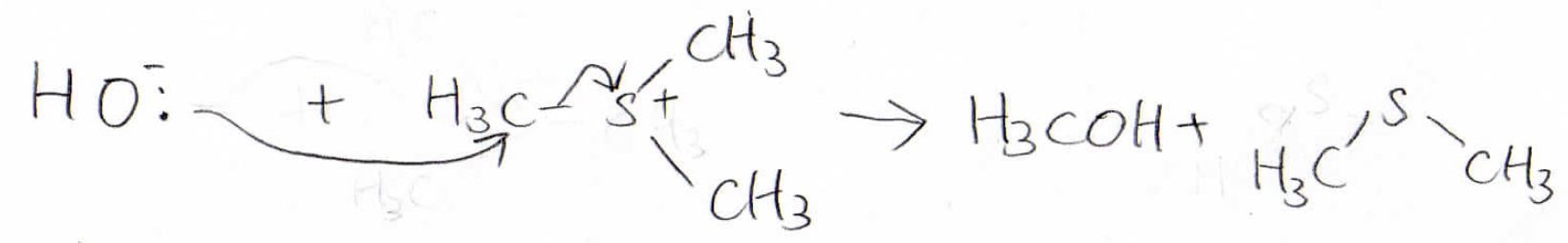
例えば、ジメチルスルフィドはヨウ化メタンに\(\displaystyle \rm{S_N}\)\(2\)反応を起こして、下のようなカチオンになります。

このイオンのことは、スルホニウムイオンと言います。
また、スルフィドは優れた脱離基としての一面ももつため、例えば、水酸化物イオンをスルホニウムイオンに求核攻撃させてアルコールを得ることもできます。
硫黄類縁体ならではの反応
最後に、硫黄類縁体ならではの反応を見ていこうと思います。
酸素原子にはできなくて硫黄原子にはできることと言えば、オクテット則に従わずに10個や12個の最外殻電子をもった形も安定して存在できることです。
チオールの酸化
例えば、チオールを酸化させると酸素原子を3個も受け入れてスルホン酸となります。
このとき、硫黄原子の最外殻電子数は12個になっています。

この反応は、反応性に富む塩化スルホニル、さらにはスルホン酸エステルの合成につなげることができます。
チオールの還元
そして、先ほどは酸化でしたが、ヨウ素分子などにより還元させると、このように\(\displaystyle \rm{S-S}\)結合をもつジスルフィドができます。
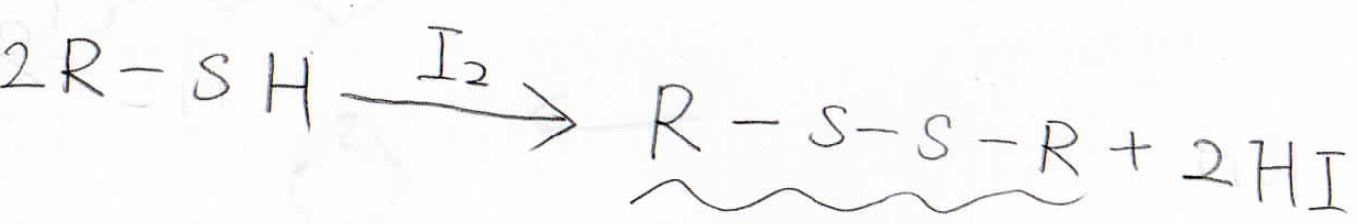
このジスルフィド結合は、酸化・還元で結合解離・形成できることから生体内でもよく使われ、タンパク質の特異的な立体構造を固定するために使われています。

この原理を利用したのが髪の毛のパーマで、酸化させた後で、髪をくしゃくしゃにして還元すれば髪の毛にクセをつけることができます。
スルフィドの酸化
スルフィドに過酸化水素水を反応させると、酸素原子を2つ受け取ってスルホンになります。
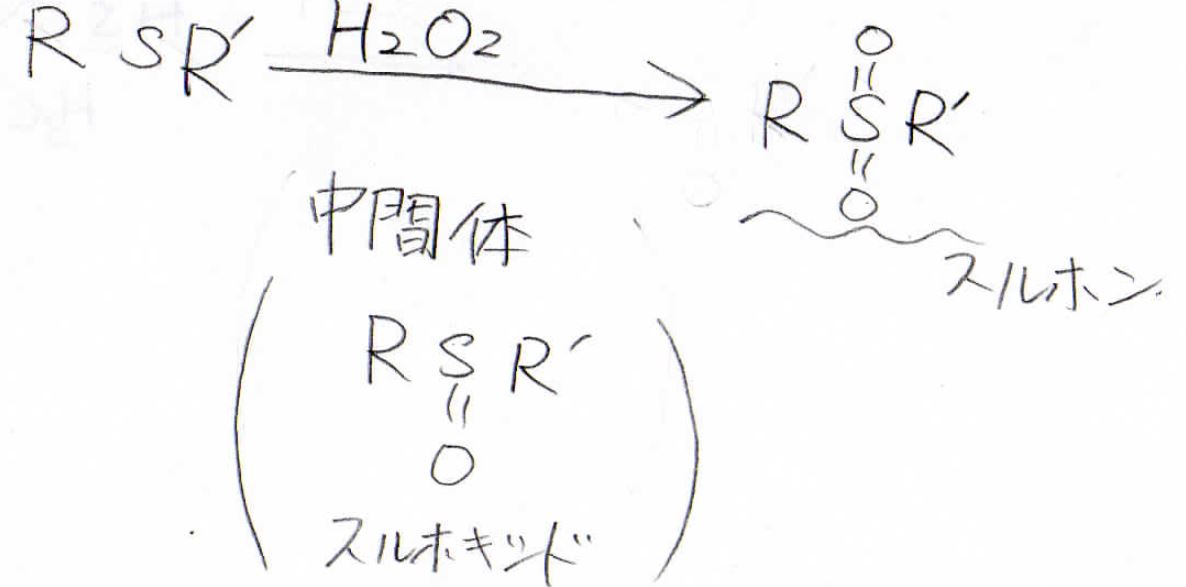
この反応はまた、酸素原子を1つだけ受け取ったスルホキシドを中間体として経由しています。
練習問題
こちらの2つの反応で主生成物となるものは何でしょうか?
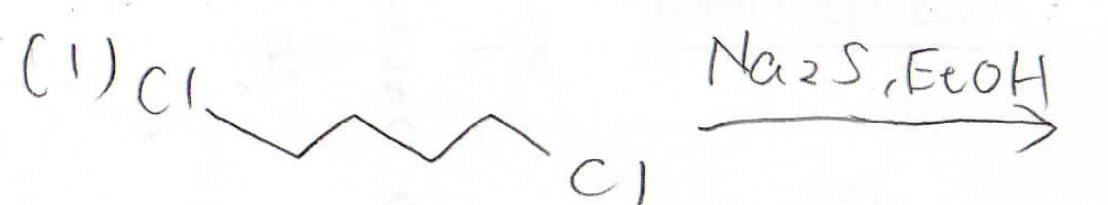
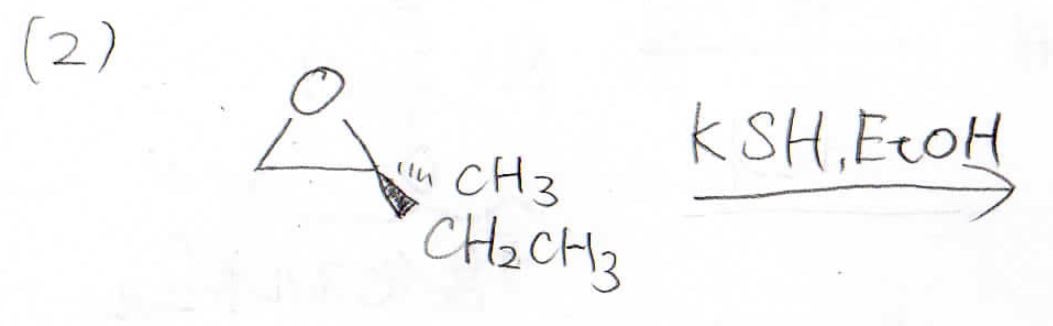

(2)はオキサシクロプロパンの開環反応であり、硫化水素イオンは立体障害の小さい左側の炭素原子に\(\displaystyle \rm{S_N2}\)機構で攻撃します。
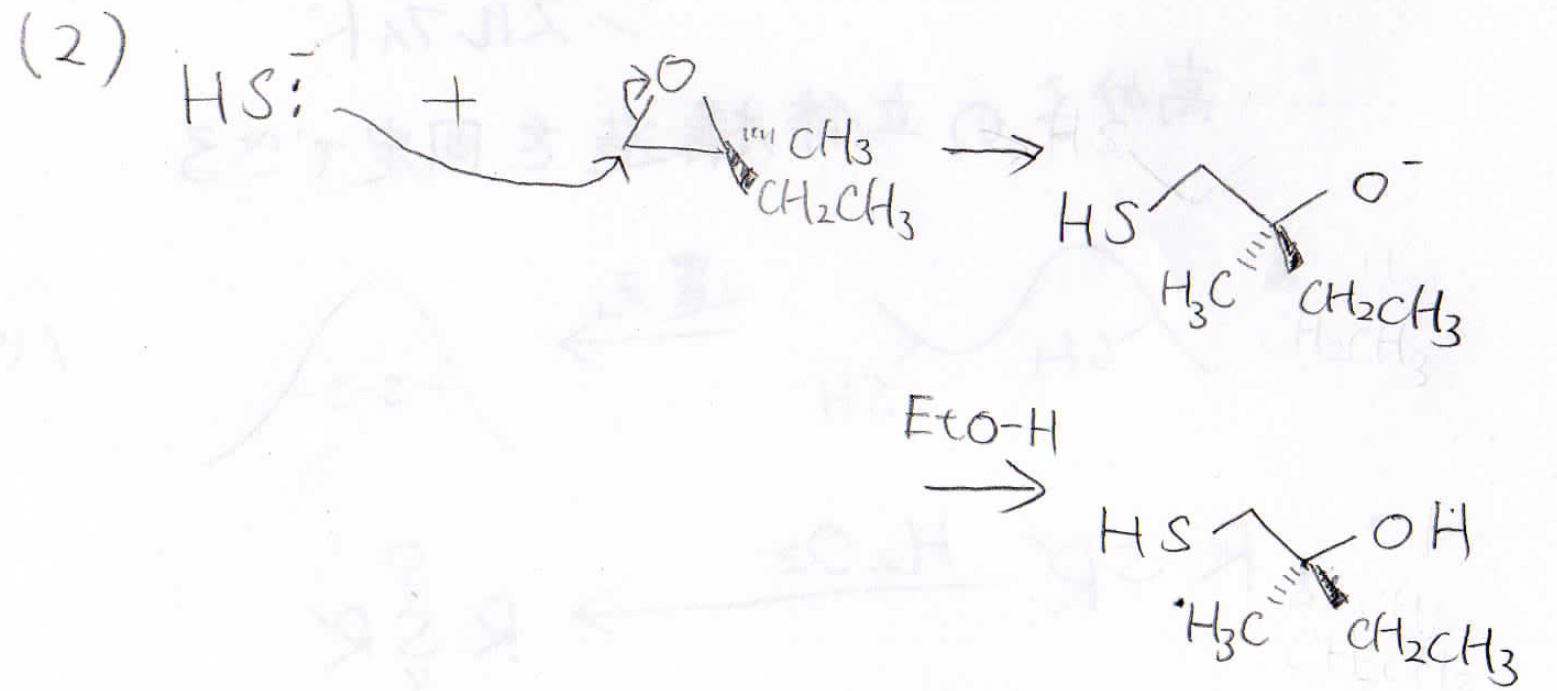
結果、立体も保持したメルカプトアルコールになります。
まとめ
はい、今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!




