こんにちは!
それでは今回も化学のお話やっていきます。
今日のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(spin-spin coupling)
それでは内容に入っていきます!
前回までのおさらい
まず、前回までのおさらいです。
NMRとは核磁気共鳴というもので、磁場をかけて2つの状態にゼーマン分裂した核スピンが特定の電磁波の吸収により共鳴する現象のことを言います。
この共鳴振動数は、近くにどんな官能基があるのかということと、外部磁場の大きさによって決まります。
官能基の推定のためには外部磁場によらない物理定数の方が都合がよいため、化学シフトという値を使います。

標準物質としてテトラメチルシランを使い、そのピークと目的のピークの共鳴振動数の差を分光計の振動数で割ったものが化学シフトです。
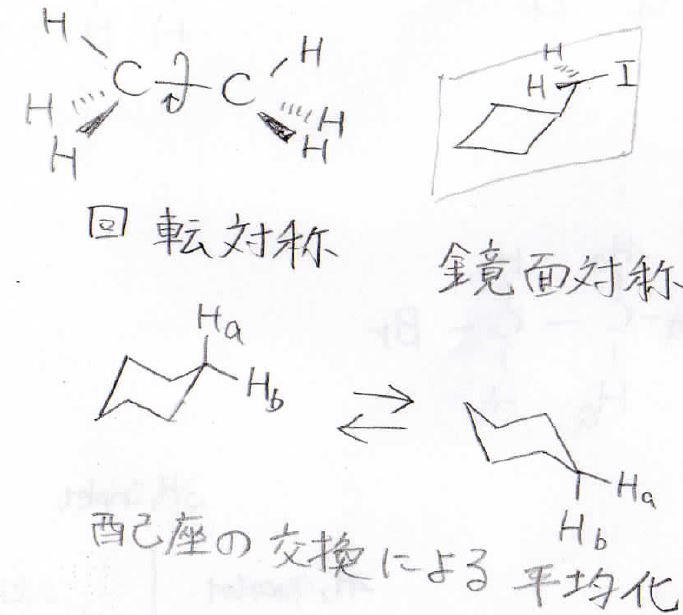
そして、化学的に等価である複数の原子核については、化学シフトの値が同じになります。
化学的に等価であるかどうかを決めるのは、回転対称、鏡面対称、そして配座の交換による平均化という要素になります。
等価な水素の個数分だけスペクトルのピークが大きく出るので、そこから等価な水素の個数比を求めることができます。
詳しくはこちらの記事をご覧ください。



隣接する水素の影響
それでは、新しい内容に入っていきます。
原子核が感じる実質の磁場の大きさは、電子由来の局部磁場に影響されますが、実は近くにある原子核のスピンにも影響されます。
例えば、2つの水素原子\(\displaystyle \rm{H_a}\)と\(\displaystyle \rm{H_b}\)がこのような位置関係にあったとします。
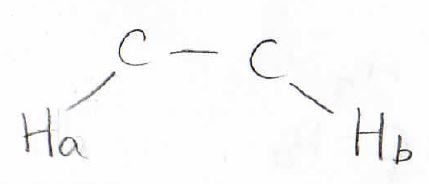
まず、\(\displaystyle \rm{H_a}\)のスピン状態が2つに分かれたとします。
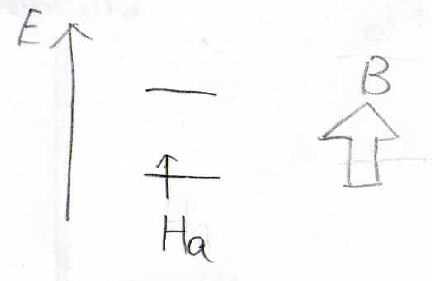
その状態で\(\displaystyle \rm{H_b}\)についても考えてみます。

\(\displaystyle \rm{H_a}\)の核スピンが影響するとすると、\(\displaystyle \rm{H_a}\)のスピンの向きにより微妙に磁場の大きさが変わってきます。
\(h_\rm{a}\)というのが\(\displaystyle \rm{H_b}\)の核が\(\displaystyle \rm{H_a}\)の核から受ける磁場の大きさで、\(\displaystyle \rm{H_a}\)のスピンが外部磁場と順平行な場合は磁場が大きくなるので、ゼーマン分裂の幅が大きくなります。
逆向きの場合は、反対にゼーマン分裂の幅が小さくなります。
結果として、1個の水素原子に対応するピークだったとしても、このように2本のピークが現れることになります。

この現象をスピン-スピン分裂と言います。
隣接水素が複数個ある場合
そして、もう少し一般的な例として、隣接する水素が複数個ある場合についても考えてみましょう。
まず、隣接水素が2個ある場合は、両方が下向き、両方が上向き、どちらか片方だけが上向きというこの4通りが考えられます。

一方が上向きでもう一方が下向きのこの2状態については、発生させる磁場の大きさに違いがないので、結局ピークは3本に分かれることになります。
中央のピークだけは2状態に対応しているので、両端のピークより高いピークとなり、その積分比は1:2:1になります。
隣接水素が3個ある場合はこのようになり、ピークの本数は4本、その積分比は1:3:3:1になります。

これを一般化したのがこちらの表になります。

一般的にピークの本数は等価な隣接水素の個数より1だけ多くできるという\(N+1\)則に従います。
そして、ピークの積分比は、パスカルの三角形で表すことができます。
この別れ方には呼び方がついており、一重線はsinglet、二重線はdoublet、三重線はtripletといいます。
カップリング定数
ここまでが分かれ方の話でしたが、分かれる幅も重要なパラメータになります。
まず、複数に分裂したピークの間隔は等間隔になり、その幅に対応する周波数の差をカップリング定数と言い、多くの場合は大文字の\(J\)で表します。
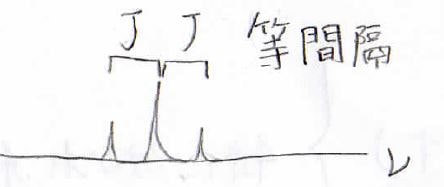
このカップリング定数は、着目している水素と隣接水素の位置関係によって決まっており、例えば、先ほど考えたものと同じこのビシナルカップリングでは、\(J\)が\(6\sim 8\ \rm{Hz}\)となることが知られています。

こっちのジェミナルカップリングでは、\(J\)は化合物によって大きく変化し、\(0\sim 18\ \rm{Hz}\)となります。
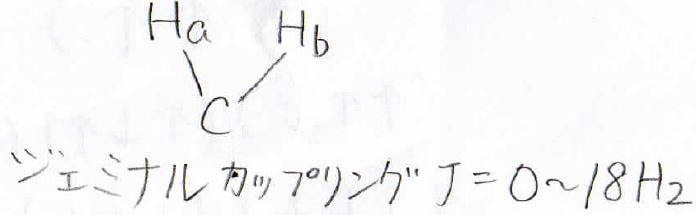
この効果は位置関係が遠いほど効きにくいので、この1,3-カップリングでは目で確認できるほど大きな分裂は起こらず、\(J\)はほとんど\(0\)になります。

NMRスペクトルからカップリング定数を計算する場合には、化学シフトでの幅を分光計の周波数にかけます。

今回やった内容は基礎的な場合のみで、もっと複雑なスピン-スピン分裂もありますので、それについては次のNMRの記事でお話ししていきますので、そちらもぜひ見てください。

練習問題
内容は以上なので、練習問題をやってみましょう。
こちらのブロモエタンと2-ヨードプロパンのNMRスペクトルを予測してください。
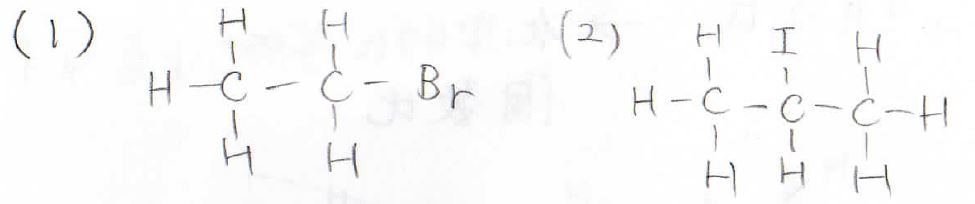
まずは等価な水素が何組あるか考えてみて、スペクトルを書いたら各ピークがどの水素に帰属しているのかもわかるように積分比を書くなり、\(\displaystyle \rm{H_a}\)や\(\displaystyle \rm{H_b}\)などと名前を付けるなりしてください。

3個の水素に対応するピークは\(1\sim 2\ \rm{ppm}\)の範囲に現れ、隣接水素が2個あるので、\(2+1\)でtripletになります。
2個の水素に対応するピークは、ブロモ基の反遮蔽化により\(3\sim 4\ \rm{ppm}\)の範囲に現れます。
隣接する水素は3個なので、quartetになります。
続いて、(2)の2-ヨードプロパンのスペクトルは、このようになります。

等価な水素原子の組み合わせは2組あり、6個の水素に対応するピークは\(1\sim 2\ \rm{ppm}\)の範囲に現れます。
隣接水素は1個なので、doubletになります。
そして、1個の水素原子に対応するピークは\(3\sim 4\ \rm{ppm}\)の範囲に現れ、隣接水素が6個もあるので、septetになります。
まとめ
はい、今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!