こんにちは!
それでは今日も化学のお話やっていきます。
今回のテーマはこちら!
動画はこちら↓
動画で使ったシートはこちら(アルキン、alkyne spectroscopy)。
アルキンの命名法
そもそもアルキンとは、炭素-炭素三重結合をもつ化合物を指します。
両方の炭素に置換基があるものを内部アルキン、片方の炭素に水素が結合しているものを末端アルキンと呼びます。
慣用名
最も単純な構造のアルキンは、アセチレンという慣用名でよく呼ばれます。
その置換体も、慣用名で呼ぶことが多いです。
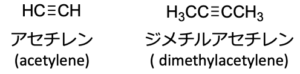
IUPAC名
主鎖に三重結合をもつ場合
IUPAC名では、アルキンが化合物の主鎖に含まれる場合は、名前の語尾に-yneを付けます。
よって、下の2つの化合物はethyneと2-buthyneになります。

側鎖に三重結合をもつ場合
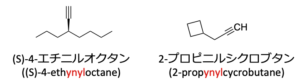
主鎖以外に含まれている場合は置換基として名前をつけることになり、そのときに使われるのが-ynyl(イニル)です。
下の化合物の名前は、(S)-エチニルオクタンと2-プロビニルシクロブタンとなります。
二重結合もある場合
例外として、二重結合と三重結合の両方を主鎖中にもつ化合物はアルケニンと呼ばれます。
このときはアルファベット順にならい、先にアルケンの -ene を、次にアルキンの -yne を付けます。
下の化合物の場合は、3-ヘキセン-1-インと1-ペンテン-4-インになります。
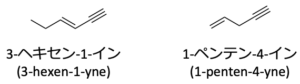
アルキンの性質
次に、アルキンの性質についてお話しします。
結合エネルギーが大きい
1つ目の重要な性質は、結合の強さです。
アルキンは結合角は\(180^\circ\)で、4原子が同一直線上に位置しています。
炭素間の距離は\(0.1203\ \rm{nm}\)で、これは二重結合の\(0.133\ \rm{nm}\)よりも短く、結合解離エネルギーもアルケンより大きく、\(299\ \rm{kcal/mol}\)もあります。
そのエネルギーは、溶接に利用されるほど大きいです。

酸性度が高い
2つ目の特徴は、高い酸性度です。
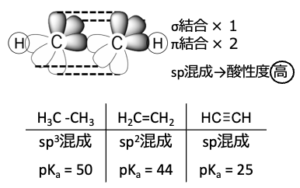
アルキンの直線的な構造は、\(\rm{sp}\)混成軌道が\(\sigma\)結合を形成したものとして理解でき、炭素どうしは1つの\(\sigma\)結合と2つの\(\pi\)結合でつながっています。
\(\rm{sp}\)軌道は、アルカンの\(\rm{sp}\)\(^3\)軌道やアルケンの\(\rm{sp}\)\(^2\)軌道よりも\(\rm{s}\)性が大きく、内殻側へ電子をひきつけます。
そのため、負電荷を安定化することができ、アルカンやアルケンに比べて酸性度が非常に高くなります。
アルキンの分光法
ここからは、アルキンの分光学的な同定方法について、お話ししていきます。
¹H-NMR
始めに、¹H-NMRについて見ていきます。
測定原理については、こちらの記事を参照してください。
\(\displaystyle \rm{sp}\)\(\)炭素に結合した水素原子は、化学シフトの値として、\(\displaystyle 1.7\sim 3.1\ \rm{ppm}\)\(\)を示すことが知られています。

したがって、\(\displaystyle \rm{sp}\)\(^3\)炭素についての\(\displaystyle 1.4\sim 1.7\ \rm{ppm}\)\(\)よりも低磁場側にピークが現れます。

一方で、反遮蔽化が起こる\(\displaystyle \rm{sp}\)\(^2\)炭素についての\(\displaystyle 5.2\sim 5.7\ \rm{ppm}\)\(\)よりは高磁場側にあることになります。
実は、アルキンでは、遮蔽化と反遮蔽化が同時に起こっているため、このような関係となります。
炭素数が\(\displaystyle 2\)の分子について、図を使って説明すると、次のようになります。
まずエチレンは、それぞれの原子中心を通る平面に対して、垂直な方向にある電子が外部磁場の影響で、局部磁場を発生させます。
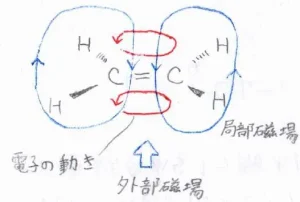
赤色で示したのが、電子の古典的な円運動で、青色で示したのが、局部磁場です。
水素原子周辺では、外部磁場と局部磁場の方向が平行に近いため、2つのスピン状態のエネルギー差はとても大きくなります。
対して、アセチレンの場合、それぞれの原子中心を通る直線に対して、垂直となる2方向に電子が存在しています。
ここに外部磁場をかけると、電子の主な循環運動は図のようになります。
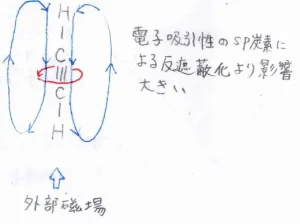
これは、エチレンのものとは垂直な方向であり、これによって発生する局部磁場は、水素原子の位置において、外部磁場を弱める方向にはたらきます。
その結果、共鳴ピークは高磁場側にきます。
ただし、\(\displaystyle \rm{sp}\)\(\)炭素そのものは\(\displaystyle \rm{s}\)\(\)性が高く、電子求引性であるため、反遮蔽化も起こり、エタンよりは低磁場側となります。
実際に、3,3-ジメチル-1-ブチンの¹H-NMRスペクトルは、こちらのような概形になります。
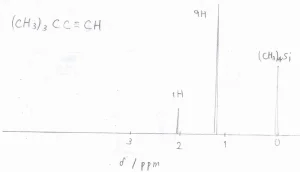
\(\displaystyle \rm{sp}\)\(^3\)炭素に結合した水素原子のピークがおよそ\(\displaystyle 1.2\ \rm{ppm}\)\(\)、\(\displaystyle \rm{sp}\)\(\)炭素に結合した水素原子のピークがおよそ\(\displaystyle 2.1\ \rm{ppm}\)\(\)になります。
そして、三重結合にはスピン-スピン結合をよく伝達するという特徴があります。
末端アルキンの末端水素は、炭素3つ分離れた水素原子とカップリングします。
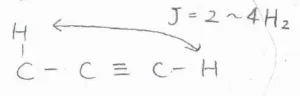
そのときのカップリング定数は、\(\displaystyle 2\sim 4\ \rm{Hz}\)\(\)です。
1-ペンチンの¹H-NMRスペクトルは、こちらのようになります。
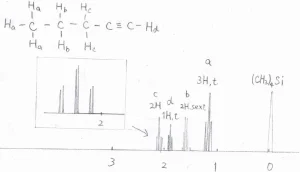
化学シフトが\(\displaystyle 1.96\ \rm{ppm}\)\(\)にある末端水素のピークは、\(\displaystyle \rm{c}\)\(\)でラベルされた2つの水素原子とカップリングして、三重線となります。
\(\displaystyle 2.16\ \rm{ppm}\)\(\)に現れる\(\displaystyle \rm{c}\)\(\)の炭素のピークは、\(\displaystyle \rm{b}\)\(\)でラベルされた2つの水素原子とアルキニル水素1つとカップリングして、二重の三重線となります。
\(\displaystyle \rm{b}\)\(\)の水素については、理論上は12本に分裂するはずですが、カップリング定数に大きな差がないので、六重線として観測されます。
¹³C-NMR
続いて、アルキンの¹³C-NMRについて、少しお話しします。
測定手法については、こちらの記事を参照してください。
三重結合している炭素は、化学シフトが\(\displaystyle 65\sim 95\ \rm{ppm}\)\(\)という狭い範囲内で共鳴します。
これは、\(\displaystyle \rm{sp}\)\(^3\)炭素の\(\displaystyle 5\sim 45\ \rm{ppm}\)\(\)、\(\displaystyle \rm{sp}\)\(^2\)炭素の\(\displaystyle 100\sim 150\ \rm{ppm}\)\(\)と大きく離れているため、識別が可能です。
1-ヘキシンについて、実際の化学シフトは、こちらのようになります。
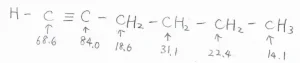
IR
続いて、アルキンの赤外分光法について、お話ししていきます。

測定原理については、こちらを参照してください。
末端アルキンの\(\displaystyle \rm{C-H}\)\(\)伸縮の吸収帯は、\(\displaystyle 3260\sim 3330\ \rm{cm}\)\(^{-1}\)に現れます。
そして、変角振動は\(\displaystyle 640\ \rm{cm}\)\(^{-1}\)周辺に現れます。
三重結合の伸縮運動の吸収帯は、\(\displaystyle 2100\sim 2660\ \rm{cm}\)\(^{-1}\)ですが、内部アルキンでは、双極子モーメントの変化が小さいため、強度は弱くなります。
そのため、内部アルキンの構造決定には、IRはあまり使えません。
実際に、1-ヘキシンについてのIRスペクトルの概形は、こちらの図のようになります。
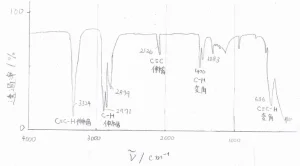
\(\displaystyle 3300\ \rm{cm}\)\(^{-1}\)あたりに、アルコールにしては狭すぎる吸収帯が見られるので、すぐに末端アルキンだと見当がつきます。
また、\(\displaystyle \rm{sp}\)\(^3\)炭素に結合した水素の吸収帯が見られるため、アセチレンではないこともわかります。
質量分析
次に、厳密には分光法ではないですが、アルキンの質量分析について、考えていきます。
測定原理については、こちらの記事を参照してください。
アルケンの場合と同様に、明確な分子イオンピークが観測されることが多く、分子量や不飽和度がわかります。
また、アルキンは三重結合から1つ離れた炭素上でフラグメント化することが知られています。
例えば、3-ヘプチンの場合、この図のように2か所で分裂が考えられます。
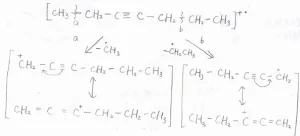
いずれも、共鳴安定化したカルボカチオンが生成します。
実際に、3-ヘプチンのMSは、こちらの図のようになります。
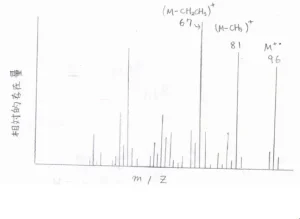
先ほどのフラグメント化で、\(\displaystyle \rm{CH}\)\(_3\)が外れたものは、分子イオンピークから\(\displaystyle \frac{m}{z}\)が\(\displaystyle 15\)だけ離れたところに現れます。
\(\displaystyle \rm{CH_2CH_3}\)\(\)が外れたものは、分子イオンピークから\(\displaystyle 29\)離れたところに観測されます。
ここで注意すべきは、\(\displaystyle \frac{m}{z}\)がさらに小さいイオンも多く存在していることです。
これは、質量分析を行う高エネルギー条件下では、三重結合の転位が起こる可能性があることによるものです。
三重結合の転位が起これば、分子量が\(\displaystyle 43\)や\(\displaystyle 57\)だけ小さくなったイオンもできることになります。
そのため、質量分析は三重結合の位置の特定方法としては役に立ちません。
アルキンの合成法
続いて、アルキンの合成法について説明します。
アルキニルアニオンからの合成
アルキンは酸性度が高いため、n-ブチルリチウムやナトリウムアミドといった強塩基を用いることで、末端水素をプロトンとして引き抜くことができます。
その結果、アルキニルアニオンと呼ばれる化学種が生成します。
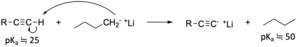
これはグリニャール試薬と似た性質をもち、ケトンやアルデヒド、エポキシドなどに求核付加してアルキンを合成できます。
第一級ハロアルカンにも求核付加することができるのが、アルキニルアニオンの特徴です。
ジハロアルカンからの合成
別のアルキン合成法として、ジハロアルカンからの合成があります。
これはアルケンのときを思い出すとわかりやすいと思います。
ハロアルカンに対してtert-ブトキシドなどの強塩基を作用させると、\(\displaystyle \rm{E2}\)脱離が起きてアルケンが得られます。
これと同様に、隣接ジハロアルカンに対して強塩基を作用させると、脱離反応が2回起きてアルキンになります。
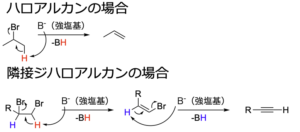
下に実際の反応例を示します。
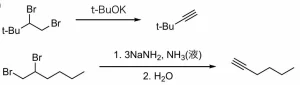
この反応は、副反応としてアルキンにしたい炭素–炭素結合の反対側で脱離反応を起こす場合があります。
そのため、1つ目では隣接炭素の片方にしか脱離する水素がない化合物を用いています。
2つ目では、3当量の塩基を加えることで、生成したアルキンをアルケニルアニオンまで変換し、平衡をアルキン側に偏らせ、水で中和することによってアルキンに戻す工夫をしています。
アセチレンの工業的な合成法
ここからは、アセチレンの工業的な合成法と利用法について、お話しします。
アセチレンは、高い熱含量をもっており、また1回だけ付加反応を起こすことで、ビニル化合物が生成することから、化学工業の主要な原料として重宝されてきました。
技術の発展に伴い、石油から直接エチレンやプロピレン、ブタジエンなどが作れるようになったので、アセチレンの工業的な用途は、いったんは縮小しました。
しかし、21世紀になり、石油の貯蔵量が心配されるようになってからは、石炭やコークスからアルケンを作る材料として、再び注目を集めています。
アセチレンはエネルギー含量が高いため、それを合成する方法も激しい条件になることが多いです。
最も古い合成法は、まず酸化カルシウムとコークスをおよそ\(\displaystyle 2000^\circ \rm{C}\)\(\)に加熱して反応させることで、カルシウムカーバイドと一酸化炭素を作ります。
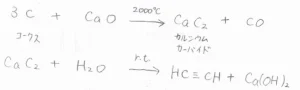
そして、常温でカルシウムカーバイドに水を加えると、アセチレンと水酸化カルシウムが得られます。
石炭から作る場合は、アーク炉内で何千度という高温にして、水素と反応させます。
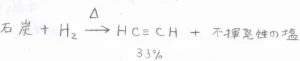
このときの変換率は、\(\displaystyle 33\%\)くらいです。
アセチレンの工業的な利用法
このようにして作られたアセチレンは、次のような反応によって、さまざまなモノマーに変換されます。
まず、触媒の存在下で、アセチレンに塩化水素を付加させると、塩化ビニルが得られます。
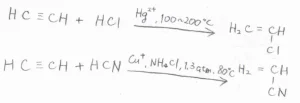
また、シアン化水素を付加させると、アクリロニトリルが得られます。
また、ニッケルカルボニル存在下で、アセチレンに一酸化炭素と水を付加させると、アクリル酸が作れます。
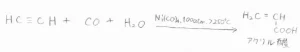
アクリル酸を原料としてできるポリアクリル酸エステルは、丈夫かつ柔軟な材料として、天然ゴムの代替品や生体医療材料として広く使われています。
そして、銅アセチリドを触媒として、アセチレンにホルムアルデヒドを1等量反応させると2-プロピン-1-オールとなり、2等量反応した場合は2-ブチン-1,4-ジオールとなります。
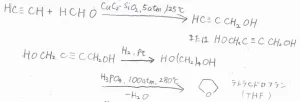
さらに、2-ブチン-1,4-ジオールに水素を付加させて1,4-ブタンジオールとした後、酸触媒で脱水すれば、有名な溶媒であるテトラヒドロフラン(THF)を作ることができます。
そのほかの利用法としては、カーボンブラックという顔料や半導体の材料としても利用されています。
また、アセチレンを重合してできるポリアセチレンは、長い\pi電子共役系をもつ導電性高分子として知られています。
アルキンの還元
次に、アルキンの還元について、お話しします。
アルカンへの還元
\(\rm{Pt}\)や\(\rm{Pd}\)を触媒として、水素ガスと反応させると、アルキンもアルカンまで還元することができます。
シス型アルケンへの還元
また、酢酸鉛やキノリンで\(\rm{Pd}\)の活性を落としたLindlar触媒という触媒を用いると、アルケンの状態で止めることができます。
Lindlar触媒は不均一触媒の一種で、触媒表面で活性化された2つの水素とアルキンの間で反応が進行してシス体のアルケンが得られます。

トランス型アルケンへの還元
トランス体が欲しい場合は、金属ナトリウムを用います。
金属ナトリウムは、1電子を放出することで電子が希ガス配置になって安定化するため、強力な電子供与体と言えます。
これを液体アンモニアに溶かして還元剤とすることで、アルキンをアルケンにすることができます。
反応機構を巻き矢印で書くと、下のようになります。
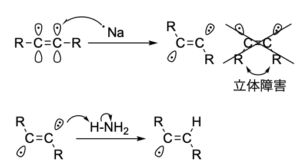
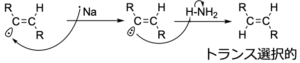
まず、アルキンの\(\rm{p}\)軌道の1つに電子が与えられラジカルアニオンになります。
この時点で、炭素はどちらも\(\rm{sp}\)\(^2\)混成に変化するのですが、立体障害のより少ないトランス中間体が選択的にできます。
そして、アニオンがアンモニアから水素を引き抜き、もう一度電子移動とプロトン化が起きることで、トランスアルケンに還元されます。
アルキンの求電子付加反応
次に、アルキンの求電子付加反応を解説します。
ハロゲン化水素・ハロゲンの付加
まず、ハロゲン化水素の付加です。
これはアルケンと同様の機構で進行し、ジェミナルジハロアルカンが生成します。
このときの位置選択性はマルコフニコフ則に従い、ハロゲンは同じ炭素原子に付加します。
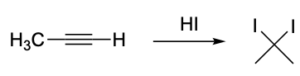
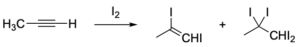
ハロゲン分子の付加も同様に進行し、テトラハロアルカンや隣接ジハロアルカンが得られます。
マルコフニコフ型の水和反応
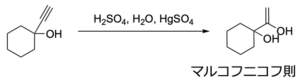
水和反応では、アルケンのときは硫酸などのブレンステッド酸触媒だけで進行しましたが、アルキンの場合はアルケニルカチオンが不安定で活性化エネルギーが大きくなります。
これにより、二価の水銀イオンや銀イオンなどのルイス酸触媒が必要になります。
また、水和で生成するエノールは不安定な構造であるため、反応系中で互変異性化して、より安定な構造であるカルボニルに平衡が偏ります。
そのため、最終的にはケトンやアルデヒドなどのカルボニル化合物が得られます。
この場合も、基本的な反応機構はアルケンへの水和と変わらないため、マルコフニコフ則に従った生成物が得られます。

逆マルコフニコフ型の水和反応
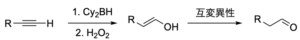
逆マルコフニコフ型の生成物が欲しい場合は、ヒドロホウ素化-酸化反応を用いますが、\(\rm{BH}_3\)を用いると、アルカンまで還元されてしまいます。
ジアルキルボランなどの嵩高いボランを用いることで反応性を抑えると、アルケンで止めることができます。
まとめ
今回の内容は以上です。
間違いの指摘、リクエスト、質問等あれば、Twitter(https://twitter.com/bakeneko_chem)かお問い合わせフォームよりコメントしてくださると、助かります。
それではどうもありがとうございました!